«»изучается в «Основы теор химии» профильного 11 класса. (Габриелян, 11 профильный)
Образовательные задачи: формирование нового знания, здесь формируем понятие Гидролиз.
Даем определение: Гидролиз – это реакция обменного разложения веществ водой. Гидролизу подвергаются различные вещества: неорганические – соли, карбиды и гидриды металлов, галогениды металлов; органические – галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды. Основное назначение гидролиза: происходит в организме человека. В организме человека создание определенной рН среды (Нр, кровь-среда какая?
Встречается 4 вида гидролиза солей: 1) соль образована сильной ктой и сильным основанием (сульфат натрия, бромид бария); 2) Соль образована слабой ктой и сильным осн-ем (карбонат натрия, ацетат натрия); 3) Соль образована сильной кислотой и слабым основанием (хлорид аммония, сульфат железа); 4) Соль образована слабой кислотой и слабым основанием (ацетат меди, нитрит никеля)
Развивающие задачи: развиваем мышление, мировоззрение, что гидролиз имеет практическое значение для организма человека.
Воспиательные задачи: учащиеся должны знать, что в организме человека и животных гидролиз углеводов происходит под действием ферментов: Крахмал пищи(С6Н10О5)n при гидролизе и действии ферментов полости рта à мальтоза далее при гидролизе и действии ферментов желудочно-кишечного тракта àглюкоза С6Н12О6 при окислении его àСО2, Н2О.
В составе крови содержатся соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Другой пример, в составе слюны человека есть ионы НРО42-. Благодаря им в полости рта поддерживается определенная среда (рН=7,0-7,5)
Гидролиз органических солей: буферные растворы, создание определенной среды, гомеостаз организма – физиологический процесс поддержания постоянства внутренней среды организма при котором различные параметры организма (кровяное давление, температура тела) поддерживаются в равновесии несмотря на изменение условий окружающей среды; и т.д.
12. Предложите вопросы обобщающей беседы при закреплении темы: «переходные элементы (Ag, Cu, Zn, Cr, Hg, Mn, Fe)».
БЕСЕДА-диалогический метод обучения, при котором учитель путем постановки тщательно продуманной системы вопросов подводит учеников к пониманию нового материала или проверяет усвоение ими уже изученного.
Беседа может быть контролирующая(фронтальный опрос), обобщающая, эвристическая. Нужно хорошо знать, какие знания, у учащихся имеются к началу беседы и какими они должны стать в конце ее. Необходимо разработать систему вопросов, логически и дидактически правильно построенную.
В ходе беседы вопросы могут быть адресованы одному ученику (ИНДИВИДУАЛЬНАЯ беседа) или учащимся всего класса (ФРОНТАЛЬНАЯ беседа).
В целом метод беседы имеет следующее преимущество:
· активизирует учебно-познавательную деятельность учащихся;
· развивает их память и речь;
· делает открытыми знания учащихся;
· имеет большую воспитательную силу;
· является хорошим диагностическим средством. Недостатки метода беседы:
· требует много времени;
· содержит элемент риска (школьник может дать не правильный ответ, который воспринимается другими уча щимися и фиксируется в их памяти);
· необходим запас знаний.
В обобщающей беседе внимание концентрируется главным образом на том, какие общие выводы должны сделать учащиеся, в результате изучения всей темы или раздела курса. Поэтому в обобщающей беседе преобладают вопросы, подводящие учащихся к генерализации знаний. При подготовке к излагающей беседе учитель выделяет главную проблему и намечает вопросы, ведущие к ее решению на базе уже имеющихся знаний.
Переходные элементы, переходные металлы, химические элементы Iб — VIIIб подгрупп периодической системы элементов Д. И. Менделеева. Особенность строения атомов П. э. заключается в незавершённости их внутренних электронных оболочек; соответственно различают d-элементы, у которых происходит заполнение 3d-, 4d-, 5d- и 6d-подоболочек, и f-элементы, у которых заполняется 4f-подоболочка (лантаноиды) и 5f-подоболочка (актиноиды). Такое строение электронных оболочек определяет некоторые специфические свойства П. э. (способность к комплексообразованию, ферромагнетизм и др.). Общее число П. э. составляет 61.
Вопросы обобщающей беседы
1. как еще можно назвать переходные элементы? где они распологаются?
Ответ: d-элементы, распологаются в побочных подгруппах ПСХЭ
2. сколько электронов содержатся на внешней электронной оболочке атомов переходных элементов?
Ответ: два, иногда один и даже нуль (у палладия) электронов.
3. В чем отличие между металлами главных и побочных подгрупп
Ответ: отличие связано с особенностями электронного строения переходных элементов, а именно с тем что во второй снаружи электронной оболочке имеется занятый электронами d-подуровень. Для образования химических связей атомы переходных элементов могут использовать не только внешние электроны, но также d-электроны и свободные d-орбитали предшествующей оболочки. Поэтому для переходных элементов значительно более характерна переменная валентность.
4. Как изменяется устойчивость соединений элементов в высшей степени окисления?
Ответ: повышается
13.Составьте план-конспект урока «Электролитическая диссоциация сильных и слабых электролитов» для естественнонаучного профиля.
Цель урока: электролитической диссоциации сильных и слабых электролитов.
1. Образовательная: актуализовать знания учащихся об основных положениях теории электролитической диссоциации, раскрыть сущность процесса электролитической диссоциации, обобщить сведения об ионах;
2. Развивающая: продолжить формирование умений сравнивать, обобщать и делать выводы;
3. Воспитательная: формировать стремление к самостоятельности, внимательности, глубокому усвоению знаний.
Метод обучения: словесно-наглядный.
Тип урока: репродуктивный
Форма обучения: традиционный урок
Средства обучения: учебник Рудзитис, Фельдман, Химия 9 класс, периодическая система химических элементов Д.И. Менделеева.
План урока
1. Организационный момент (2 мин)
2. Объяснение нового материала.(41 мин)
3. Домашнее задание (2мин)
Ход урока
| Этапы урока | Деятельность учителя | Деятельность учащихся |
| Организационный момент(1 мин) | - Здравствуйте! Садитесь. Открываем тетради, пишем сегодняшнее число и тему нашего урока. Провести перекличку учащихся по журналу. | Здравствуйте! Готовятся к уроку. В тетрадях пишут число, тему. |
Изучение новой темы (40 мин)
 Закреление
Закреление
 Домашнее задание (2 мин)
Домашнее задание (2 мин)
| Сегодня мы пройдем новую тему, которая называется «Слабые и сильные электролиты. Степень диссоциации».
До сих пор мы рассматривали электролиты, которые в водных растворах полностью распадаются на ионы. Возникает вопрос: все ли электролиты в одинаковой степени распадаются на ионы? Какова доля диссоциированных молекул у различных электролитов? При каких условиях процесс диссоциации смещается влево, а при каких влево?
Если опустить в конц раствор хлорида натрия электроды прибора для определения электрич провод-ти лампочка в нем засветится ярко, а в конц-м рре уксусной к-ты –неярко. При добавлении воды к рру уксусной кты лампочка начинает светиться все ярче. Разбавление же рра хлорида натрия почти не влияет на яркость свечения лампочки. Т.к. электрич провод-сть зависит от числа ионов в рре, то след-но, хлорид натрия даже в конц-х ррах почти не диссоц-т. при разбавлении рра уксусной кты число диссоц-х молекул увел-ся.
На этом основании след.выводы:
1.Некоторые электролиты независимо от их концентрации в водных ррах полностью диссоц-т на ионы (хлорид натрия).
2.Известны электролиты, которые диссоц-т частично (смещение равновесия).
3.Отношение числа диссоц-х молекул к общему числу молекул, нах-ся в рре, называют степенью диссоциации (альфа).
Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными (полностью распад на ионы), со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами (незначительно диссоц-т).
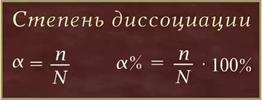 1.Используя понятие «степень дисс», объясните смысл понятий «сильная кта» и «слабая кта».
2.приведите примеры сильных и слабых электролитов. Где на практике необходимо учитывать силу электролитов.
Упраж и задачи.
1.Используя понятие «степень дисс», объясните смысл понятий «сильная кта» и «слабая кта».
2.приведите примеры сильных и слабых электролитов. Где на практике необходимо учитывать силу электролитов.
Упраж и задачи.
| Ученики записывают в своих тетрадях. Записывают домашнее задание. |
14. Предложите свои варианты экспозиций для кабинета химии для сельских малокомлектных школ. Интерьер кабинета химии должен отвечать современным требованиям, и прежде всего особенностям преподавания предмета, ведь качество обучения, эффективность труда и отдыха, состояние здоровья учащихся и учителя зависят и от правильного оформления интерьера тоже. Переднюю стену кабинетахимии в нашей и классная доска, над которой висят таблицы «Электрохимический ряд напряжений металлов», «Относительная эл ектроотрицгтел ьность элементов», «Периодическая система химических элементов Д. И. Менделеева», слева — «Качественные реакции на катионы и анионы». Для увеличения рабочей поверхности классной доски используем съемную магнитную доску, на которой размещена схема распределения электронов в атоме. В левом переднем углу кабинета находится демонстрационный вытяжной шкаф.На боковой стене без оконных проемов висят стенды для экспозиции учебных пособий постоянного пользования: «Минералы», «Техника безопасности в картинках к лабораторным работам», «Правила безопасности в кабинете химии», «Периодическая система химических элементов Д. И. Менделеева», «Растворимость кислот, оснований и солей в воде», «Строение атома», «Химическая связь», «Занимательная химия».У задней стены кабинета -размещены шкафы для хранения учебных пособий и оборудования для абораторных работ. В открытой нише одного из шкафов находятся установки для получения газов., а также шаростержневые модели молекул органических веществ. В другой нише шкафа находятся химическая посуда и лабораторные принадлежности.Над шкафами висят портреты ученых-химиков.Для экспонирования сменного материала в нашем кабинете имеется следующее оборудование.Подставка переносная для таблиц ненная родителями учащихся. Она состоит из основания и выдвижной стойки с зажимом. Изготовлена из онкостенных стальных труб. Высота подставки — от 1850 до 2650 мм.Этажерка для сушки посуды, дно которой затянуто железной оцинкованной проволочной сеткой.Пятиярусный штатив с постоянным набором реактивов для рабочего места учителя. В гнездах штатива расположены склянки с неорганическими и органическими веществами. Разная окраска этикеток облегчает распределение веществ в штативе по классам. Расположение склянок в шахматном порядке позволяет хорошо видеть каждую этикетку. Одно гнездо — резервное: его заполняют в случае, если на уроке потребуется реактив одноразового пользования. В то же время это гнездо — символическая граница, отделяющая неорганические вещества от органических.Поскольку7 большинство химических реакций, предусмотренных школьной программой, проводят с целью изучения качественных изменений, то осуществлять их лучше полумикрометодом. Это позволяет экономить реактивы, а также повышает безопасность проведения опытов. Такие опыты мы проводим на пластине для капельного анализа. Наличие в ней 8 у него дублений (гнезд) позволяет проводить некоторые реакции в сравнении, поскольку гнезда находятся рядом. Пластина для капельного анализа изготовлена из пластмассы размером 130 х 80 х 5 мм, в которой в два ряда расположены 8 ячеек диаметром 17мм и глубиной 8 мм. Такие пластины сделаны с помощью специально изготовленного металлического пресса.Стойка для склянок с реактивами, изготовленная из дна двух пластиковых бутылок и одноразового шприца, скрепленных между собой саморезом. На выступах сделаны отверстия для склянок из-под пенициллина.
15 Предложите варианты организации исследовательской работы учащихся по химии для сельских мало комплектных школ. Цель: совершенствование и расширение теоретических знаний, практических умений и привитие и с с л е д о в ат е л ь с к и х навыков по химии. Формы работы: 1 направл ение: связь иссл. работ ~~с учебными темами-— включения их в программу. Н-р, элективные курсы исследовательского характера (анализ воды, химия в быту); 2 направление: использование исследовательской работы во внеклассной работе (кружки, факультативы): 3 направление: летняя практика, где осуществляются исследовательские проекты.