«Оксиды халькогенов. Кислые и средние халькогениды»
Кислые и средние халькогениды. Их свойства, общие принципы получения, применение:
1. Халькогениды - соединения халькогенов с металлами.
Термин халькогенид используется для обозначения сульфидов, селенидов, теллуридов и полонидоа, но не оксидов.
Степень окисления элемента неметалла в халькогенидахвсегда —2.
Существуют средние (нормальные) халькогениды с общей формулой 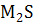 и кислые (гидросульфиды, гидроселениды и т.д.) с общей формулой MHS, где М -- одновалентный металл.
и кислые (гидросульфиды, гидроселениды и т.д.) с общей формулой MHS, где М -- одновалентный металл.
2. Сульфиды и гидросульфиды.
2.1. Общие свойства сульфидов:



Сульфидыщелочных и щелочноземельных металлов имеют состав M2S, MS с высокой энтальпией образования, высокими температурами плавления.
Сульфиды d- и f-металлов имеют сложный состав, например, MS, M5S7, M3S4, MS2, MS3 и др. Обладают высокой термической устойчивостью, снижающейся при увеличении в молекулах числа атомов серы.
Сульфидыp-элементовлегко окисляются, разлагаются водой, растворяются в кислотах.
2.2. Химические свойства гидросульфидов на примере гидросульфида натрия:
§ Водные растворы гидросульфида натрия имеют щелочную реакцию вследствие гидролиза по аниону:
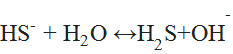 (4)
(4)
кипячение раствора сильно сдвигает равновесие вправо (за счёт удаления сероводорода).
§ При взаимодействии со щелочами образуется средняя соль:
{\displaystyle {\mathsf {NaHS+NaOH\ {\xrightarrow {\ }}\ Na_{2}S+H_{2}O}}} 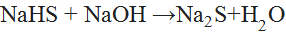 (5)
(5)
§ Легко разрушается кислотами:{\displaystyle {\mathsf {NaHS+HCl\ {\xrightarrow {\ }}\ NaCl+H_{2}S\uparrow }}}
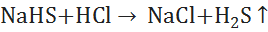 (6)
(6)
§ В щелочной среде с серой образует полисульфиды:
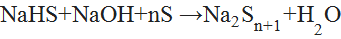 (7){\displaystyle {\mathsf {NaHS+NaOH+nS\ {\xrightarrow {\ }}\ Na_{2}S_{n+1}+H_{2}O}}}
(7){\displaystyle {\mathsf {NaHS+NaOH+nS\ {\xrightarrow {\ }}\ Na_{2}S_{n+1}+H_{2}O}}}
§ Окисляется, например, кислородом, до серы, которая образует полисульфиды:
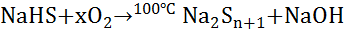 (8)
(8)
2.3 Получение сульфидов и гидросульфидов:
1. Н{\displaystyle {\mathsf {NaHS+xO_{2}\ {\xrightarrow {100^{o}C}}\ Na_{2}S_{n+1}+NaOH}}}епосредственное соединение элементов: 
2. Взаимодействие гидроокисей с сероводородом:
Этим методом получают сульфиды щелочных металлов. Сначала получается кислый сульфид (гидросульфид). Затем прибавляют равное количество щелочи для его перевода в нормальный сульфид:
NaOH + H2S = NaHS + H2O (9)
NaHS + NaOH = Na2S + H2O(10)
3. Восстановление сульфатов прокаливанием с углем:
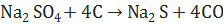 (11)
(11)
2. 4. Применение сульфидов и гидросульфидов.
Сульфиды находят применение как полупроводниковые материалы (CuS, PbS,), в органической химии, в медицине, для производства красок, в сельском хозяйстве и др.
3. Селениды, теллуриды и полониды.
Селениды.ителлуриды получаются при непосредственном взаимодействии металлов с селеном и теллуром или могут быть осаждены из растворов их солей при пропускании H2Se или H2Te. Во многом аналогичны сульфидам.
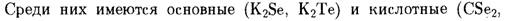

Полониды обычно синтезируют путем прямой реакции между элементами при температуре около 300-400 ° С, либо электролитически. Они являются одними из наиболее химически стабильных соединений полония. Ливермолий не образует халькогениды.
Оксиды халькогенов. Их свойства, принципы получения, применение:
Кхалькогенам относят кислород (О), серу (S), селен (Se), теллур (Te), полоний (Ро) и ливермолий (Lv)
1. О2(Кислород)
Связываясь только с менее электроотрицательными элементами, будучи в степени -2 кислород образовывает оксиды. Они составляют почти ВСЕ соединения кислорода, исключение, например, дифторид кислорода OF2.Важнейшим из оксидов является оксид водорода  вода.
вода.
2. S(Сера)
· 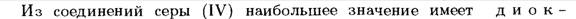
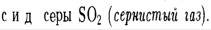
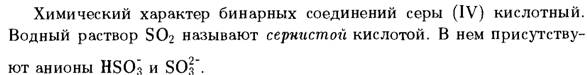
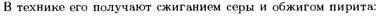

· Другой оксид серы (VI)  или серный ангидрид.
или серный ангидрид.

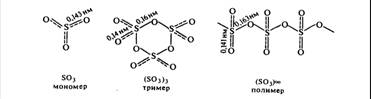

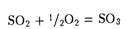
Серный ангидрид в основном используют в производстве серной кислоты и в металлургии.
3. Подгруппа селена

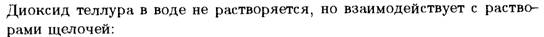
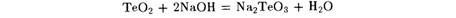
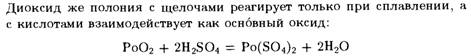
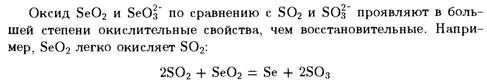
Главными областями применения селена и его соединений являются электротехника, производство стекла и резиновая промышленность.
В электротехнике теллур применяется как детекторный металл в радиоприборах и в сплавах высокого сопротивления. В стекольной и керамической промышленности соединения теллура применяют для окраски стекла глазурей и эмалей в синий цвет.
Вопросы:
1. Какие ещё физические свойства у сульфидов?
Сульфидов щелочных и щелочноземельных являются солеподобными веществами, растворяются в воде (в том числе с разложением), способны окисляться до сульфатов и разлагаются кислотами. Могут образовывать полисульфиды.
Сульфиды d и f металлов нерастворимы в воде, способны разрушаться при действии горячих концентрированных растворов серной и соляной кислот, окисляются при действии сильных окислителей. При нагревании на воздухе окисляются до оксидов и сульфатов.
2. Можешь назвать больше областей применения сульфидов и гидросульфидов?
Сульфиды щелочноземельных металлов, цинка и кадмия (ZnS, CaS) служат основой люминофоров, используются в химической и в лёгкой промышленности; так Na2S, CaS, BaS и NaHS применяются в кожевенном производстве для удаления волосяного покрова с кож.
3. Какие ещё, свойства имеют селениды и теллуриды?
Селениды и теллуриды щелочных металлов растворимы в воде. В присутствии воздуха раствор обычно окрашен вследствие окисления, протекающего с выделением элементарных селена и теллура и образования полиселенидов и полителлуридов (аналогичных полисульфидам).
Селениды и теллуриды тяжелых металлов в воде не растворимы, а у активных металлов проявляют полупроводниковые свойства. У соединений тяжелых малоактивных металлов с селеном и теллуром высокая электропроводность.
4. Почему мало известно про элемент ливермолий и что о нём можно сказать?
Искусственно синтезированный радиоактивный элемент. Открыт не так давно (Ливерморий открыт путём синтеза изотопов в 2000 г. в Российском Объединённом институте ядерных исследований в сотрудничестве с Ливерморской национальной лабораторией (в США).) Ввиду отсутствия в природе ливерморий не играет никакой биологической роли. Если бы удалось создать достаточно большое количество этого элемента, он был бы очень радиотоксичен из-за высокой радиоактивности.