Введение
Антибиотики – это химические соединения биологического происхождения, оказывающие избирательное повреждающее или губительное действие на микроорганизмы. Антибиотики, применяемые в медицинской практике, продуцируются актиномицетами (лучистыми грибами), плесневыми грибами, а также некоторыми бактериями. К этой группе препаратов относят также синтетические аналоги и производные природных антибиотиков. Термин «антибиотики» появился в 1942 году и происходит от слова «антибиоз» (от греч. anti – против, bios - жизнь), означающего антогонизм между организмами. Антибиоз впервые был описан французским ученым Л. Пастером, наблюдавшим подавления развития бацилл сибирской язвы микроорганизмами других видов.
Капли с содержанием антибиотика используют против бактериальных инфекций, вирусно-бактериальных или грибковых заболеваний. Антисептические препараты не содержат антибиотиков и обладают противомикробным действием. Антисептические средства устраняют инфекцию и предотвращают ее размножение. Они обладают функционалом убивать микроорганизмы, оказывать системное воздействие и гипоаллергенны, соответственно, имеют мало противопоказаний. Сульфацил растворимый представляет собой глазные капли с противомикробным действием.
Задачи: описать подробную схему синтеза сульфацила растворимого (sulfacylum natrium) на основе N4-карбометоксисульфаниламида. Рассчитать выход реакции каждой стадии и суммарный выход, если исходного N4-карбометоксисульфаниламида взято в количестве 10 кг. Укажите возможные побочные процессы и область применения.
Цель работы: ознакомиться с методикой синтеза сульфацила ратворимого и изучить области его применения. Рассчитать загрузки исходных компонентов и теоретический выход получаемого вещества.
Часть 1. Область применения
Сульфацил растворимый - сульфаниламидный антибактериальный препарат широкого спектра действия. Обладает бактериостатическим эффектом, активен в отношении грамположительных и грамотрицательных кокков, Escherichia coli, Shigella spp, Vibrio cholera, Clostridium perfringens, Bacillus anthracis, Corynebacterium diphtheriae, Yersinia pestis, Chlamydia spp, Actinomyces israelii, Toxoplasma gondii. Механизм действия препарата обусловлен конкурентным антагонизмом с парааминобензойной кислотой (ПАБК) и конкурентным угнетением дигидроптероатсинтетазы, что приводит к нарушению синтеза тетрагидрофолиевой кислоты, необходимой для синтеза пуриновых и пиримидиновых оснований. Вследствие этого нарушается синтез нуклеиновых кислот (ДНК и РНК) бактериальных клеток и тормозится их размножение.
Показания к применению: гнойные язвы роговицы, инфекционные конъюнктивиты, блефариты, профилактика и лечение гонорейных заболеваний глаз у новорожденных и взрослых, профилактика бленнореи новорожденных, профилактика гнойных осложнений после травм и операций на глазах.
Необходимо следить за тем, чтобы при закапывании кончик флакона-капельницы не контактировал с другими предметами или поверхностями. В случае появления раздражения тканей назначают растворы меньшей концентрации.
Пациенты с повышенной чувствительностью к фуросемиду, тиазидовым диуретикам (гидрохлортиазиду), производным сульфонилмочевины (глибенкламиду), ингибиторам карбоангидразы (диакарбу) могут иметь повышенную чувствительность к сульфацилу растворимому.
Часть 2. Схемасинтеза сульфацила растворимого
1 стадия

I II
2 стадия

II III
3 стадия

III IV
4 стадия

IV V
Методика синтеза
1. N4-Карбометоксисульфанилацетамид.Смешивают 97%-ного уксусного ангидрида и 98%-ного N4-карбометоксисульфаниламида, поддерживая при этом температуру 15-18 °С. Если масса очень густая, добавляют 1 г ледяной уксусной кислоты. Затем при той же температуре перемешивают в течение часа, добавляют хлористого цинка, растворенного в ледяной уксусной кислоте, и продолжают перемешивание 20 мин. Масса постепенно начинает густеть. Ее подогревают до 90-92 °С и поддерживают эту температуру 10-14 ч, затем приливают 40 мл воды, нагревают до кипения, застывшую массу размельчают, охлаждают до 30-35 °С, фугуют и промывают холодной водой до слабокислой реакции по конго.
2. Натриевая соль сульфанилацетамида (III). К 12%-ному раствору едкого натра при 18-20 °С прибавляют отфугованной пасты. Размешивают 12-14 ч при 23-25 °С. Если проба через 8-9 ч показывает, что омыление не закончилось (неполное растворение осадка в избытке разбавленной соляной кислоты), загружают дополнительное количество щелочи. Всего на омыление расходуется 22 г (0,55 моль) щелочи.
По окончании омыления реакционную массу охлаждают до 18-20 °С и избыточную щелочность нейтрализуют соляной кислотой по фенолфталеину.
К раствору прибавляют гидросульфита, угля, размешивают 20 мин, охлаждают до 12-14 °С и фильтруют. Уголь промывают водой, которую присоединяют к основному раствору, и передают на следующую стадию.
3. Сульфанилацетамид (IV). К раствору III прибавляют 28%-ной соляной кислоты до полного выделения IV. Конец выделения IV контролируется по pH 3. IV отжимают, промывают холодной водой до отсутствия в промывной воде Сl– (с AgNО3) и сушат 16 ч при 70-80 °С.
4. Сульфацил растворимый (V). К смеси воды, 98%-ного IV приливают 42%-ного раствора едкого натра до pH 8-9. Раствор нагревают до 60 °С и перемешивают 20 мин, проверяя реакцию среды. Избыточную щелочность снимают 20%-ной уксусной кислотой, прибавляют гидросульфита и угля. Раствор (pH 8-9) перемешивают 30 мин, фильтруют, нагревают до 50-60 °С и оставляют охлаждаться на 8 ч, после чего дают выдержку 8 ч при 12-14 °С. Выпавший V фугуют, промывают спиртом, отжимают и сушат при 60-70 °С до содержания влаги не выше 1%.
Часть 3. Расчеты
1 стадия: m(I) = 10 кг = 10 000 г
М(I) = 171.19 г/моль
M(II) = 213.23 г/моль
n(I) = 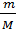 =
= 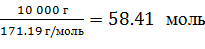 ; (1)
; (1)
n(II) = n(I)= 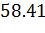 моль
моль
m(II) = n ⋅  =
=  ⋅ 213.23 = 12455.75 г; (2)
⋅ 213.23 = 12455.75 г; (2)
m(pract.) = 10624.75 г
η = 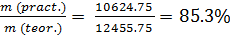 ; (3)
; (3)
2 стадия: m(II) = 12455.75 г
М(II) = 213.23 г/моль
M(III) = 236.22 г/моль
n(II) = 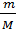 =
= 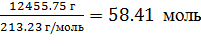 ; (1)
; (1)
n(III) = n(II)= 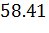 моль
моль
m(III) = n ⋅  =
= 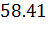 ⋅ 236.22 = 13797.61 г; (2)
⋅ 236.22 = 13797.61 г; (2)
m(pract.) = 8692.49 г
η =  ; (3)
; (3)
3 стадия: m(III) = 13797.61 г
М(III) = 236.22г/моль
M(IV) = 214.24 г/моль
n(III) = 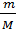 =
= 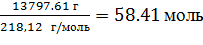 (1)
(1)
n(IV) = n(III)= 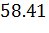 моль
моль
m(IV) = n ⋅  =
=  ⋅ 214.24 = 12513.76 г (2)
⋅ 214.24 = 12513.76 г (2)
m(pract.) = 11362.49 г
η =  (3)
(3)
4 стадия: m(IV) = 12513.76 г
М(IV) = 214.24 г/моль
M(V) = 254.24 г/моль
n(IV) = 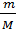 =
= 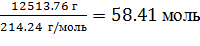 ; (1)
; (1)
n(V) = n(IV)= 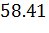 моль
моль
m(V) = n ⋅  =
= 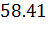 ⋅ 254.24= 14850.16 г; (2)
⋅ 254.24= 14850.16 г; (2)
m(pract.) = 9667.45 г
η = 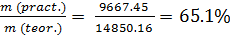 ; (3)
; (3)
Выводы
1. Ознакомились с литературными данными лекарственного препарата сульфацил растворимый;
2. Ознакомились с методикой синтеза сульфацила растворимого. Сульфацил растворимый получают из N 4 -ацил-сульфаниламида (I) (полупродукт в производстве белого стрептоцида) путем введения ацильной группы в положение N 1 с образованием N-ацетил-N-ацилсульфаниламида (II) с последующим омылением N-ацильного остатка. Получаемый при этом сульфацил (IV) превращают в натриевую соль – сульфацил растворимый (V);
3. Провели расчет материального баланса реакционного процесса и расчет выхода полученного вещества.
Список литературы
1. Беликов В.Г. Фармацевтическая химия. Учебное пособие. 4-е изд., перераб. и доп. – М.: Медпресс-информ, 2007. – 624 с.
2. Беликов В.Г. Синтетические и природные лекарственные средства. М.: Высшая школа, 1993.
3. Вартанян Р.С. Синтез основных лекарственных средств. – М.: Медицинское информационное агентство, 2004. – 845 с.
4. Джилкрист Т. Химия гетероциклических соединений. М.: Мир, 1996. – 464 с.
5. Евстигнеева Р.П. Тонкий органический синтез. М.: Химия, 1991. – 184 с.
6. Клиническая фармакология.: учебник для вузов / Под ред. В.Г. Кукеса.- 4-е издание., перераб. и доп., - М.: ГЭОТАР-Медиа, 2009. – 1056 с.
7. Лукевиц Э., Игнатович Л. Гетероциклы на мировом рынке лекарственных средств. Рига: Ин-т орг. синтеза, 1992. – 40 с.
8. Солдатенков А.Т., Колядина Н.М., Шендрик И.В. Основы органической химии лекарственных веществ – М. Химия, 2001 – 192 с.