Физические константы органических веществ. Принципы качественного и количественного анализа органических веществ
Критериями чистоты вещества могут служить различные физические свойства, которые являются постоянными для индивидуальных веществ и меняются в присутствии примесей. К ним относятся температура плавления твердого вещества, температура кипения жидкости, плотность, показатель преломления. Наиболее просто установить тождество неизвестного соединения с известным (идентификация), а также доказать его чистоту, определив его физические константы и сравнив их с имеющимися литературными данными. Вещество можно признать чистым только тогда, когда физические константы его не изменяются после повторной очистки.
Все измерения должны проводиться при определенных условиях, поскольку, например, температуры плавления и кипения индивидуальных веществ зависят от давления; плотность и показатель преломления – от температуры, а хроматографическое разделение – от состава элюента. Точность измерения зависит от правильности показания приборов, поэтому термометры и мерная посуда должны быть тщательно откалиброваны. Существенную роль играет чистота посуды.
Физические константы органических веществ:
1. Определение температуры плавления
2. Определение температуры кипения
3. Определение относительной плотности
4. Определение показателя преломления
Качественный анализ органических соединений должен обязательно предшествовать количественному анализу, так как методика последнего видоизменяется в зависимости от того, какие элементы входят в состав исследуемого вещества. Качественный анализ имеет также и самостоятельное значение как один из способов идентификации органических соединений.
Качественный анализ органического соединения дает возможность выяснить, из каких элементов оно состоит.
Качественный анализ органических соединений должен обязательно предшествовать количественному анализу, так как методика последнего видоизменяется в зависимости от того, какие элементы входят в состав исследуемого вещества.
Задачей количественного органического элементарного анализа является определение процентного содержания отдельных элементов, входящих в состав органического вещества.
Принцип анализа, предложенный еще сто лет назад Либихом и не претерпевший существенных изменений до настоящего времени, заключается в разрушении органического вещества путем сожжения с последующим количественным улавливанием продуктов сгорания. Что касается техники проведения анализа, то она в настоящее время достигла существенных успехов. Несомненно, самым значительным достижением явилась разработка микроаналитического метода, при котором для проведения количественного элементарного анализа требуется всего лишь несколько миллиграммов вещества.
Так называемый «макроанализ», для проведения которого требовалось брать навески в 0,2-0,5 г вещества, постепенно теряет свое значение. Если в промышленности он еще имеет некоторое применение, то научные лаборатории в настоящее время работают только с навесками в несколько миллиграммов (микроанализ) или в крайнем случае в несколько десятков миллиграммов (полумикроанализ). В последние годы начал развиваться ультрамикроанализ (навески в 0,1-0,01 мг).
Правильно ли следующее утверждение: если при бромировании непредельного углеводорода избытком брома образовался тетрабромид, это-углеводород ацетиленового ряда. Почему? Ответ подтвердите уравнениями реакции
Будучи непредельными соединениями, алкины вступают в первую очередь в реакции присоединения. Эти реакции протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, - в одинарную.

Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
HC ≡ CH + Br2 → CHBr = CHBr + Br2 → CHBr2 - CHBr2
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Качественная реакция; бромная вода обесцвечивается.
Строение карбоксильной группы. Химические свойства карбоновых кислот: образование солей, функциональных производных, восстановление, окисление
Карбоксильная группа

состоит из карбонила

и гидроксила -ОН.
Но для карбоновых кислот не характерны ни альдегидные, ни спиртовые свойства.

является самостоятельной функциональной группой, характерной для класса карбоновых кислот. Это объясняется электронным строением и взаимным влиянием функциональных групп и радикала.

взаимодействуют с р-электронами кислорода гидро-ксигруппы, а это приводит к сопряжению. Поляризация связи С=0 резко возрастает за счет дополнительного стягивания неподеленной пары электронов (р-электронов) атома кислорода ОН-группы. Вследствие такого смещения электронной плотности связь О—Н в гид-роксигруппе ослабляется, и атом водорода легко отщепляется в виде иона Н-. Поэтому именно гидроксигруппа участвует почти во всех реакциях: она или замещается, или диссоциирует по кислотному типу.
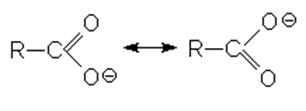
В отличие от альдегидов, для карбоксильной группы не характерна карбонильная активность. Это объясняется электронным строением карбоксилат-иона:

В карбоксилат-ионе происходит перераспределение электронной плотности между двумя атомами кислорода и углеродом. В результате двойная связь практически отсутствует в растворах кислот:

Так как влияние атомов взаимно, карбоксильная группа оказывает влияние на радикал. В результате этого атомы водорода соседнего с функциональной группой отличаются большей подвижностью от других атомов водорода радикала и могут замещаться.

Большинство реакций карбоновых кислот может быть отнесено к одному из четырех основных типов:
1.Реакции, сопровождающиеся разрывом О-Н-связей, например, кислотная диссоциация.
2.Реакции по карбонильному углероду, которые имеют нуклеофильный характер.
3.Реакции расщепления
4.Реакции по -углеродному атому алкильной группы.
По сравнению со спиртами карбоновые кислоты обладают более высокой кислотностью. При этом в растворе реализуется равновесие.

Способность к отдаче к протонам обусловлена двумя факторами: поляризацией связей О-Н в исходном состоянии и стабилизацией карбоксилат-аниона из-за деколализации отрицательного заряда в нем посредством резонанса.
Кислотность карбоновых кислот характеризуется константой кислотности Ка или показателем рКа. Их значения обычно составляет приблизительно 10-5, что свидетельствует о слабости этих кислот. Присутствие в структуре радикала электроноакцепторных заместителей будет стабилизировать карбоксилат анион, что приведет к увеличению кислотности соответствующей ему кислоты. Например: рКа монохлоруксусной кислоты составляет 2,9 а уксусной – 4,8. По мере удаления электроноакцепторного заместителя от карбоксильной группы кислотность снижается, что связано с быстрым затуханием индуктивного эфекта: так рКа -хлорпропионовой кислоты составляет ~4,0. Наоборот, увеличение разветвления алкильного радикала приводит к снижению кислотности, так как при этом возрастает индуктивный эффект алкильной группы. На основе этих данных можно представить следующие ряды кислотности карбоновых кислот.


Кислотность карбоновых кислот проявляется в их взаимодействии с активными металлами и основаниями.
2RCOOH + 2Na 2RCOONa + H2
RCOOH + NaOH RCOONa + H2O
2RCOOH + Na2CO3 2RCOONa + H2O + CO2
В кислой среде (pH<3) диссоциация карбоновых кислот практически не происходит, так как равновесие (1) существенно смещено в левую сторону из-за избытка ионов HSol. В то же время в кислой среде осуществляется протонирование карбоновых кислот по основному карбонильному кислороду.

В протонированной форме оба кислородных атомов становятся одинаковыми:

Несмотря на малую концентрацию протонированной формы присутствие небольших количеств сильных кислот исключительным образом влияет на реакционную способность карбоновых кислот: повышение положительного заряда на карбонильном углероде делает его восприимчивым к атаке нуклеофильными реагентами и открывает возможность для протекания многих реакций нуклеофильного замещения карбоновых кислот.