Тема: Ионная связь. Металлическая связь.
Класс: 11
Цель: сформировать представление у учащихся по изучению ионной и металлической связей.
Задачи:
Образовательные
· формировать представление об ионных и металлических типах химической связи;
· изучить особенности строения ионных и металлических кристаллах.
Развивающие
· продолжить развитие представлений о влиянии строения вещества на его свойства на примере веществ с ионной и металлической связь;
· совершенствовать умения определять типы химической связи в веществах.
Воспитывающие
· формирование научной картины мира на основе разных типов химических связей, и многообразия химических веществ.
Тип урока: формирование новых знаний
Методы обучения: словесный (рассказ, беседа), наглядный.
Средства обучения: Химия: учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И.Е. Шиманович и др.; под ред. И.Е. Шимановича. – Минск: Адукацыя i выхаванне, 2013.− 296с., периодическая система химических элементов Д.И.Менделеева.
План урока:
1. Организационный момент;
2. Проверка домашнего задания;
3. Актуализация знаний;
4. Новый материал;
5. Физкультминутка;
6. Этап закрепления знаний;
7. Рефлексия;
8. Домашнее задание;
9. Литература.
Ход урока
Организационный момент
Приветствие. Проверка отсутствующих.
Проверка домашнего задания
Проверочная робота по теме «Ковалентная связь». Работа выполняется 20 минут.
| 1 вариант 1.Сколько электронных пар осуществляют химическую связь в молекуле азота: а) 6; б) 3; в) 4; г) 2? 2. В молекулах, каких из перечисленных веществ все ковалентные связи относятся к σ-типу: H2O, CH4, N2, CO2, H2 3. Приведите по пять примеров молекул, в которых атомы связаны между собой ковалентной неполярной и ковалентной полярной связями. 4. Какие из приведённых утверждений неверны: а) ковалентная связь между двумя атомами одного химического элемента является неполярной; б) ковалентная связь между атомами разных химических элементов в большинстве случаев является полярной; в) двухатомная молекула с полярной связью обладает дипольным моментом, т.е. является диполем; г) для образования полярной связи необходимо образование трех общих электронных пар; д) общая электронная пара смещается к более электроотрицательному атому? 5. Приведете электронную формулу и электронно-графическую схему атома азота. Какое число и какие химические связи может образовать атом азота с атомами водорода? Запишите структурную формулу соединения азота с водородом. Какое число связующих и неподеленных электронных пар имеется в этой молекуле? |
| 2 вариант 1. Число электронных слоев и число электронов на внешнем электронном слое атомов марганца соответственно равны: 1) 4 и 7; 2) 4 и 2; 3) 7 и 4; 4) 4 и 5. 2.В молекулах, каких из указанных веществ ковалентные связи являются полярными, а каких – неполярными: H2O, HCI, CI2, CH4, N2, H2, CO2, HF? 3. Какое число связующих и какое число неподелённых электронных пар имеется в следующих молекулах: азота, воды, серной кислоты, хлороводорода? 4. Какие из приведённых утверждений неверны: а) сигма-связь может быть образована перекрыванием s- и р-орбиталей; б) пи-связь может образовываться при перекрывании s- и р-орбиталей; в) между двумя атомами в молекуле могут образовываться две сигма-связи; г) два атома в молекуле могут быть связаны только двумя π-связями; д) тройная связь в молекуле может состоять из трех σ-связей? 5.Приведите электронную формулу и электронно-графическую схему атома углерода в невозбужденном состоянии и возбужденном состояниях. Какое число и какие химические связи может образовывать атом углерода в возбуждённом состоянии с атомами водорода? Приведите структурные формулы двух соединений углерода с водородом. |
Ответы:
1вариант
1.б
2. H2O, CH4, H2.
3. Неполярная ковалентная связь: CI2, O2, N2, H2, I2.
Полярная ковалентная связь: HF, HCI, HI, C-H, C-O.
4. а, г.
5.  - электронная формула азота
- электронная формула азота
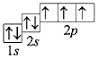 - электронно-графическая формула азота
- электронно-графическая формула азота
 3 связующие электронные пары, 1 неподеленная электронная пара.
3 связующие электронные пары, 1 неподеленная электронная пара.
2 вариант
1.1
2. Неполярная ковалентная связь: CI2, N2, H2.
Полярная ковалентная связь: H2O, HCI, CH4, CO2, HF.
3. N2 – 3 связующих электронные пары, 2 неподеленные электронные пары.
H2O – 2 связующие электронные пары, 2 неподеленные электронные пары.
H2SO4 − 8 связующих электронные пар, 10 неподеленных электронных пар
HCI – 1 связующая электронная пара, 3 неподеленных электронных пар.
4. б, г, д.
5. 6С  - электронная формула углерода
- электронная формула углерода
 - электронно-графическая формула углерода.
- электронно-графическая формула углерода.
В возбужденном состоянии образуется 4 химические связи.

Актуализация знаний
Учитель: Что мы изучаем с вами в течение нескольких уроков?
Ученики: Химическую связь.
Учитель: Что мы знаем о химической связи? Ученики: Типы химических связей, их механизмы образования. Учитель: Какой тип химической связи мы изучили? Ученики: Ковалентную: неполярную и полярную. Учитель: Какую химическую связь называют ковалентной?
Ученики: Ковалентная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков.
Учитель: На доске даны формулы веществ, распределите их по типам связи.
Формулы веществ: NaCl, O2, HCl, Na, K2, H2S, Mg, H2, Al. У каких веществ вы затруднились определить тип химической связи? Что это за вещества, определите по периодической системе? А если образуется простое вещество металл? Какой вид связи может быть в этих веществах?
Ученик: Металлическая и ионная связи
Составление кластера
Химическая связь
↓
Типы химической связи
↙ ↓ ↘
Металлическая Ионная Ковалентная
↙ ↘
Неполярная Полярная
Новый материал
Учитель: Рассмотрим ионную связь. Ионная связь образуется как правила между атомами типичных металлов и типичных неметаллов. Характерное свойство металлов – отдавать электроны, а типичные не металлы способны их присоединять.
Рассмотрим возникновение ионной связи на примере NaCI.
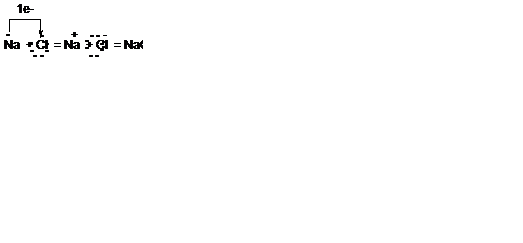
Ионная связь возникает не только между простыми катионами и простыми анионами, и между простыми катионами и сложными анионами.
Ионы противоположного знака образуют ионные кристаллы. Кристаллы ионных соединений состоят из катионов и анионов, которые располагаются определенном образом в пространстве благодаря равновесию, притяжению и отталкиванию.

Металлическая связь
Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Давайте выясним, что удерживает атомы металла в едином объеме.
Атомы большинства металлов на внешнем уровне содержат небольшое число электронов – 1,2,3. Эти электроны легко отрываются, и атомы металлов превращаются в ионы.
Ме0 – n ē ⇆ Men+
Оторвавшиеся электроны перемещаются от одного иона к другому, связывая их в единое целое. Разобраться, какой электрон принадлежит, какому атому − невозможно. Поэтому все оторвавшиеся электроны становятся общими.
Электроны могут соединяться с катионами, тогда временно образуются атомы, от которых снова отрываются электроны. Этот процесс происходит бесконечно. Таким образом, в объеме металла атомы непрерывно превращаются в ионы и наоборот.
Оторвавшиеся электроны при сближении атомов свободно движутся от одного иона к другому. При этом небольшое число общих электронов связывает большое число атомов и ионов металла. Т. к. число электронов в металле равно общему заряду положительных ионов, то в целом металл остается электронейтральным.
Связь в металлах между атомами и ионами, образованная за счет обобществления электронов, называется металлической.
Теперь давайте подумаем, на какой вид связи похожа металлическая связь?
Ученик: На ионную связь. Происходит образование катионов, ē связывают ионы Ме за счет электростатического притяжения.
На ковалентную связь. Основана на обобществлении ē. Только при ковалентной связи объединяются электроны только соседних атомов, а при металлической электроны принадлежат всем атомам.
Учитель: Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов – сплавов, находящихся в твердом и жидком состоянии.
Металлической связью обусловлены основные свойства металлов:
- электропроводность
Электроны движутся в объеме металла беспорядочно. Но даже небольшой разности потенциалов достаточно, чтобы электроны начали двигаться упорядоченно. Лучшими проводниками тока являются Ag, Cu, Au, Al.
- пластичность
Электроны смягчают перемещение ионов под внешним воздействием. Самыми пластичными являются Au, Ag, Cu.
- металлический блеск
Свет поглощается металлом, и электроны начинают испускать свои волны излучения. Лучше других отражают свет Ag, Cu, Al, Pd, Hg.
Физкультминутка
Учитель:
1. И.п. - стоя. 1 - отвести согнутые руки назад, соединить лопатки -вдох, 2 - руки вперед, как бы обнять себя - выдох. Повторить 8-10 раз.
2. И.п. - стоя. Закрыть глаза, крепко зажмуриться на 1-2 сек., затем открыть глаза. Повторить 8-10 раз.
3. И.п. - стоя, кисти к плечам. Круговые движения в одну и в другую сторону. Повторить 6-8 раз каждой рукой.
4. И.п. - стоя. Круговые движения глазами в одну и в другую сторону. Повторить 10-15 раз в каждую сторону.
5. И.п. - стоя, ноги врозь. 1-3 - наклоны туловища в сторону и возврат в и.п. повторить по 4-6 раз в каждую сторону.
6. И.п. - стоя, указательный палец правой руки держать перед носом на расстоянии 25-30 см. смотреть на палец в течение 4-6 сек, затем закрыть ладонью левой руки глаз на 4-6 сек. Смотреть на палец правым глазом, затем открыть левый глаз и смотреть на палец двумя глазами. Проделать то же, но закрыть правый глаз. Повторить 4-6 раз.
Закрепление знаний
Учитель: Выберите формулы веществ
а) с ковалентной полярной связью: Cl2, KCl, NH3, O2, MgO, CCl4, SO2;
б) с ионной связью: HCl, KBr, P4, H2S, Na2O, CO2, CaS.
Ученик:
а) KCl, NH3, CCl4, SO2;
б) KBr, Na2O, CaS.
Учитель:
Найдите лишнее:
а) CuCl2, Al, MgS
б) N2, HCl, O2
в) Ca, CO2, Fe
г) MgCl2, NH3, H2
Ученик:
а) Al;
б) HCl;
в) CO2;
г) MgCl2.
7. Рефлексия:
«Оцени себя на уроке»
Учащимся дается индивидуальная карточка, в которой в которой нужно подчеркнуть фразы, характеризующие работу ученика на уроке по трем направлениям
Урок Я на уроке Итог
1.интересно 1.работал 1.понял материал
2.скучно 2.отдыхал 2.узнал больше, чем знал
3.беразлично 3.помогал другим 3. Не понял
Литература
1. Химия: учеб. для 10-го кл. учреждений общ. сред. образования с рус. яз. обучения / И.Е. Шиманович и др.; под ред. И.Е. Шимановича. – Минск: Адукацыя i выхаванне, 2013.− 296с;
2. Лахвич Ф. Ф. Химия в таблицах и схемах: пособик для учащихся общеобразоват. учреждений с рус. яз. обучения \ Ф.Ф. Лахвич, О.М Травникова.− Минск: Аверсэв,2009.−160с.− (Школьникам, абитуриентам, учащимся);
3. https://www.myshared.ru/slide/208430/#