При соприкосновении двух разнородных твердых тел или жидких фаз вследствие взаимодействия поверхностных молекул возникает связь, называемая адгезией ("прилипанием"). Адгезия, следовательно, характеризует прилипание вещества одной фазы к веществу другой фазы и измеряется работой разрыва (или сопротивления разрыву) соприкасающихся фаз на единицу площади контакта. Межмолекулярное сцепление между молекулами одной фазы называют когезией. Расчет работы адгезии и работы когезии иллюстрирует рис. 28.2.
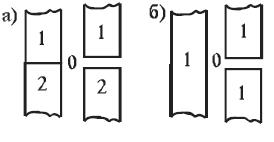
Рис. 28.2. Иллюстрация расчета работы адгезии (а) и работы когезии (б)
При разрыве столбика единичного сечения двух различных фаз (см. рис.28.2 (а)) затрачивается энергия на возникновение поверхностей раздела этих двух фаз с воздухом (фаза 0) с поверхностным натяжением σ10 и σ20, соответственно. При этом перестает существовать поверхность раздела этих фаз между собой, характеризующаяся поверхностным натяжением σ12. Тогда работа адгезииWаможет быть рассчитана следующим образом:
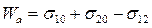 , (28.9)
, (28.9)
Если же происходит разрыв столбика единичного сечения одной фазы (см. рис.28.2.(б)), то работа когезии Wкзатрачивается на образование двух единичных поверхностей с поверхностным натяжением
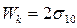 , (28.10)
, (28.10)
Сопоставление величины работы когезии и адгезии дает наглядное представление о соотношении сил сцепления между молекулами одного вещества (жидкого или твердого тела) и молекулами двух разнородных жидких или твердых тел. Адгезия между двумя твердыми телами обычно весьма мала, поскольку из-за неровностей поверхности истинная площадь контакта твердых тел гораздо меньше, чем кажущаяся площадь соприкосновения. Поэтому использование уравнения (28.9) в случае двух тел не вполне правомерно.
В случае одновременного контакта трех фаз - капля жидкости на поверхности твердого тела - условия равновесия системы будут определяться соотношением взаимной адгезии этих фаз. Вследствие стремления системы к минимуму поверхностной энергии подвижная граница жидкой фазы может изменять форму. Капля жидкости, нанесенная на поверхность твердого тела или другой жидкости, может либо растекаться по поверхности, смачивая ее, либо оставаться на поверхности в виде капли (линзы).
Рассмотрим систему, состоящую из капли жидкости 1, нанесенной на поверхность твердого тела 2 в среде газа 0, когда жидкость смачивает твердое тело (рис. 28.3).
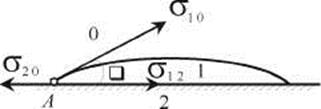
Рис. 28.3. Трехфазная система, состоящая из капли жидкости 1, нанесенной на поверхность твердого тела 2 в среде газа 0 (жидкость смачивает твердое тело)
Периметр капли на поверхности твердого тела является границей соприкосновения всех трех сред одновременно. В точке А, находящейся на этой границе, приложены три силы: сила поверхностного натяжения на границе жидкость - газ σ10, сила поверхностного натяжения на границе твердое тело - газ σ20 и сила межфазного натяжения на границе твердое тело - жидкость σ12. Каждая из этих сил направлена перпендикулярно границе взаимодействия трех фаз (периметру капли на поверхности), тангенциально к соответствующей поверхности раздела и стремится сократить эту поверхность.
Угол θ между поверхностью капли и поверхностью твердого тела, измеряемый со стороны жидкости, называется краевым углом или углом смачивания. Форма капли в состоянии равновесия соответствует минимуму энергии системы. При этом

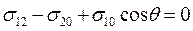 (28.11а)
(28.11а)
Или
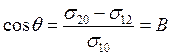 (28.11б)
(28.11б)
Последнее уравнение называют уравнением Юнга. Величина В = cosθ определяется соотношением величины поверхностной энергии Гельмгольца твердого тела на границе с жидкостью(σ12) и газовой фазой(σ20)и является критерием способности жидкости смачивать твердое тело.
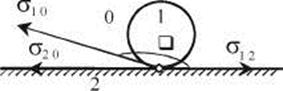
Рис. 28.4. Трехфазная система, состоящая из капли жидкости 1, нанесенной на поверхность твердого тела 2 в среде газа 0 (жидкость не смачивает твердое тело)
Значения В = cosθ лежат в пределах - 1 < cosθ < 1. Если угол  острый (рис. 3.2) и cosθ > 0, то есть σ20 > σ12, жидкость смачивает твердое тело. Если угол θ тупой (рис. 3.3) и cosθ < 0, то жидкость не смачивает твердое тело. В этом случае σ12 > σ20
острый (рис. 3.2) и cosθ > 0, то есть σ20 > σ12, жидкость смачивает твердое тело. Если угол θ тупой (рис. 3.3) и cosθ < 0, то жидкость не смачивает твердое тело. В этом случае σ12 > σ20
Удобнее условия смачивания представлять себе с точки зрения работы адгезии Wa и когезии Wк. Из уравнений (28.9) и (28.11а) следует, что
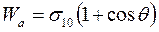 . (28.12)
. (28.12)
Отсюда, с учетом (28.10) получается (2Wa/WK)-1= cosθ. Следовательно, при Wк < 2 Wa (адгезия жидкости более чем вдвое превышает ее когезию к твердому телу), то есть при 2Wa / Wк > 1, cosθ > 0, θ< 90° (рис.28.3) и cмачивание наблюдается. При Wк > 2 Wa, (когезия жидкости более чем вдвое превышает ее адгезию к твердому телу), т.e. при 2Wa / Wк < 1, cosθ < 0, θ> 90° и тогда жидкость не смачивает твердое тело. Если же Wa = Wк (тем более, если Wa > Wк), то cosθ = 1, краевой угол равен нулю и жидкость растекается по поверхности твердого тела или другой жидкости с образованием в пределе мономолекулярного слоя.
Таким образом, условием хорошего смачивания жидкостью твердого тела является слабое взаимодействие между ее молекулами (слабая когезия). Жидкости с малым поверхностным натяжением обычно хорошо смачивают поверхности. Например, углеводороды, имеющие малые значения поверхностного натяжения, смачивают практически любую поверхность. Ртуть же, имеющая большое значение поверхностного натяжения, практически не смачивает твердые тела.
Системы, для которых характерно сильное межмолекулярное взаимодействие вещества дисперсной фазы с дисперсионной средой, называются лиофильными. Это взаимодействие приводит к образованию соль-ватных (в случае с водой - гидратных) оболочек из молекул дисперсионной среды вокруг частиц дисперсной фазы. Для лиофильных систем характерно самопроизвольное диспергирование. Поверхности, хорошо смачиваемые жидкостью, являются лиофильными, а в случае смачивания водой - гидрофильными.
Системы, в которых самопроизвольное диспергирование не происходит, называют лиофобными, а в случае с водой - гидрофобными. Поверхности, не смачиваемые жидкостью, являются лиофобными, не смачиаемые водой - гидрофобными. К веществам с гидрофобной поверхностью относятся все углеводороды и другие органические соединения с большими углеводородными радикалами. Из неорганических соединений к веществам со сравнительно гидрофобной поверхностью относятся графиты, сера, сульфиды тяжелых металлов.
Если твердое тело погрузить в жидкость, происходит смачивание его поверхности. При этом исчезает граница твердое тело - газ и возникает граница твердое тело - жидкость. Так как полная энергия поверхности раздела в первом случае больше, чем во втором, то во время процесса смачивания происходит выделение энергии в форме теплоты. Эта выделяющаяся энергия называется теплотой смачивания и представляет собой убыль полной энергии при образовании новой межфазной поверхности жидкость - твердое тело. В случае, когда жидкостью является вода, теплота смачивания может служить мерой гидрофильности или гидрофобности поверхности. Часто краевой угол бывает невозможно определить (например, при смачивании порошков) и тогда теплота остается единственной характеристикой смачивания.
Различие смачивания водой поверхностей разнообразных веществ лежит в основе процессов флотации, широко используемых при обогащении полезных ископаемых. Смачивание играет первостепенную роль в процессах стирки, крашения тканей и тому подобных. В ряде случаев требуется снижение смачивания поверхностей (повышение краевого угла). Так, например, вода не должна смачивать ткань зонта, плаща или палатки, по возможности гидрофобными должны быть строительные материалы. Для защиты различных материалов от действия воды широко применяется процесс гидрофобизации поверхностей, для чего чаще всего используется обработка органическими или кремнийорганическими соединениями, содержащими полярные функциональные группы.
Если работа адгезии больше работы когезии, то капля жидкости, нанесенная на поверхность другой жидкости или твердого тела, не будет существовать в виде капли, а будет растекаться по поверхности, образуя тонкие слои или поверхностные пленки. Разность между работами адгезии и когезии f = Wa - Wк называют коэффициентом растекания. При f > 0 растекание жидкости происходит, при f < 0 растекания нет. Таким образом, условие растекания капли жидкости 1 по поверхности жидкости 2 является соотношение Wa - Wк > 0, или, с учетом уравнений (28.2) и (28.3),
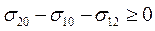 (28.13)
(28.13)
Следовательно, растеканию жидкости 1 по поверхности жидкости 2 способствует малая величина σ10 и σ12и большая величина σ20.
Неполярная жидкость хорошо растекается по поверхности более полярной жидкости, например, нефть по воде. Это явление приводит к образованию очень тонких пленок на поверхности воды. Подобным действием обладают все вещества, молекулы которых содержат длинную углеводородную цепь с присоединенными к ней полярными группами -ОН, -СООН, -NO2, -SO3H и т. п. Растекающееся по поверхности воды вещество образует на ней тонкие слои, толщина которых часто не превышает размеров молекул - мономолекулярные или монослои. Более того, растекание вещества по поверхности может не ограничиваться образованием сплошного конденсированного монослоя. При наличии свободной поверхности будет образовываться еще более разбавленный слой, молекулы которого могут и не взаимодействовать между собой, то есть образовывать как бы двумерный газ. Подобно молекулам обычного (трехмерного) газа они стремятся равномерно распределиться по всей поверхности (двумерному объему) пленки и поэтому обладают давлением расширения или поверхностным давлением π. При уменьшении площади поверхности пленки это давление увеличивается. Измерение зависимости поверхностного давления от площади пленки - один из основных методов исследования поверхностных монослоев.
Зависимость поверхностного давления π от площади s, занимаемой одним молем вещества, исследовал Ленгмюр (рис. 28.5). Резкое увеличение поверхностного давления при сжатии пленки отвечает образованию сплошного мономолекулярного слоя, в котором молекулы плотно прижаты друг к другу. Если площадь s, на которой размещен 1 моль вещества, разделить на число Авогадро, то получим площадь, непосредственно занимаемую одной молекулой.
π 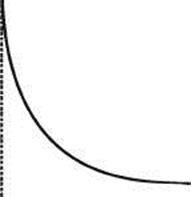
 ω S
ω S
Рис 28.5. Зависимость поверхностного давления π от площади s, занимаемой 1 молем вещества
Было показано, что размер площади, приходящийся на одну молекулу, например, жирной кислоты, в конденсированной пленке не зависит от длины углеводородной цепи. Из этого следует вывод, что в конденсированной пленке молекулы ориентированы перпендикулярно к поверхности. Таким образом, площадь, приходящаяся на одну молекулу в плотном монослое, определяется размерами полярной группы и не зависит от длины углеводородного радикала.
Капиллярная конденсация
Наряду с адсорбцией в пористых телах наблюдается явление капиллярной конденсации. Капиллярная конденсация представляет собой конденсацию пара адсорбата при давлениях, меньших давления насыщенного пара. В результате адсорбции стенки пор оказываются покрытыми тонкой пленкой адсорбированного вещества. Это обеспечивает хорошее смачивание стенок жидким сорбатом и поэтому в порах легко образуется вогнутый мениск жидкости. Согласно уравнению Томсона (Кельвина) давление пара, равновесное вогнутой поверхности, меньше упругости насыщенного пара:
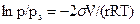 . (28.14)
. (28.14)
Поэтому конденсация пара в порах над вогнутым мениском начинается при давлениях, меньших давления насыщенного пара (p < ps), т.е. при относительном давлении меньше единицы (p / ps < 1).
Для адсорбентов с переходными порами (мезопорами) характерна изотерма адсорбции с петлей капиллярно - конденсационного гистерезиса (рис.28.6). Адсорбции соответствует нижняя кривая (1.), а десорбции -верхняя (2); десорбция как бы "запаздывает", она происходит при меньших по сравнению с адсорбцией давлениях. При малых давлениях, когда не происходит капиллярной конденсации, гистерезиса не наблюдается. Начало его появления зависит от природы адсорбента и адсорбата.
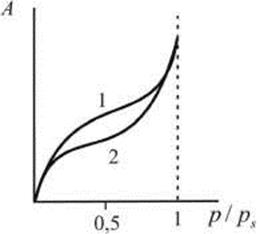
Рис. 28.6. Изотерма адсорбции с петлей капиллярно - конденсационного гистерезиса
Считается, что пористую структуру адсорбента можно смоделировать тремя видами пор: а) конусообразными, б) цилиндрическими с одним открытым концом и в) цилиндрическими с двумя открытыми концами (рис 28.7). Конденсация в конусообразных порах начинается со дна пор, где кривизна наибольшая. По мере заполнения поры радиус мениска увеличивается (уменьшается кривизна), поэтому для дальнейшего заполнения пор необходимо увеличивать давление (рис. 28.7 а). Процесс десорбции идет в обратном направлении и описывается той же кривой.
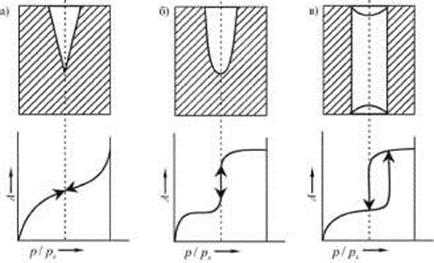
Рис. 28.7. Виды пор в пористой структуре адсорбентов
В цилиндрических порах с одним открытым концом конденсация начинается также со дна пор, где кривизна сферическая и поэтому наибольшая (рис. 28.7 б). Так как пора цилиндрическая, то она заполняется целиком при определенном радиусе мениска, что отвечает и определенному давлению пара. Капиллярная конденсация в этих порах тех же размеров также происходит обратимо. Если цилиндрическая пора тех же размеров имеет оба открытых конца (рис. 28.7. в), то конденсация начинается на стенках цилиндра, имеющего кривизну в два раза меньше, чем у сферы того же радиуса. Поэтому заполнение поры происходит при большем давлении пара в соответствии с соотношением
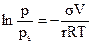 , (28.15)
, (28.15)
Конденсация на стенках цилиндрической поры уменьшает диаметр поры, что приводит к ее мгновенному заполнению при давлении, отвечающем началу конденсации. На концах поры образуются сферические мениски жидкости. Десорбция может начаться только при давлении, соответствующем радиусам кривизны этих менисков, т. е. определяемых уравнением (28.14). Таким образом, опорожнение капилляра происходит при меньшем давлении, чем его заполнение. Этим объясняется появление петли капиллярно - конденсационного гистерезиса. Так как реальные адсорбенты имеют поры различных форм и размеров, которые заполняются и опорожняются при разных давлениях, то реальные изотермы адсорбции имеют вид, представленный на рис. 28.6.
В уравнение Томсона (Кельвина), описывающего капиллярную конденсацию, входит радиус кривизны мениска и это позволяет использовать его для расчета функции распределения пор по размерам.
Чтобы получить функцию распределения для данного адсорбента, нужно знать зависимость dVП / dr от r, где VП - общий объем пор, r -значения радиусов пор. Эта зависимость называется дифференциальной кривой распределения. Она четко характеризует полидисперсность системы. Для получения кривых распределения используют десорбционную ветвь изотермы адсорбции, так как именно она отвечает сферическим менискам для всех без исключения пор. Каждой точке кривой соответствует определенная величина адсорбции А и относительное давление пара р/рs. Зная величину А, можно вычислить объем заполненных пор при данном давлении:
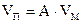 , (28.16)
, (28.16)
где VМ - мольный объем адсорбата в конденсированном состоянии.
Эффективный радиус сферического мениска rэ, соответствующий данному относительному давлению р /рs, находят по уравнению (28.14). Так как при заполнении пор капиллярной конденсации предшествует адсорбция, то истинное значение радиуса пор равно сумме радиуса мениска при полном смачивании и толщины адсорбционного слоя tадс
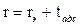 . (28.17)
. (28.17)
Толщину адсорбционного слоя tадс обычно определяют в отдельном эксперименте на непористом адсорбенте той же природы (то есть при отсутствии капиллярной конденсации):
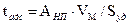 , (28.18)
, (28.18)
где АНП - величина адсорбции на непористом адсорбенте при соответствующем давлении.
Зная объем заполненных пор при данном давлении VП и соответствующие значения радиусов, строят интегральную кривую распределения объема пор VП = f (r) (рис. 28.8 а). Затем с помощью графического дифференцирования строится дифференциальная кривая распределения (рис. 28.8 б).
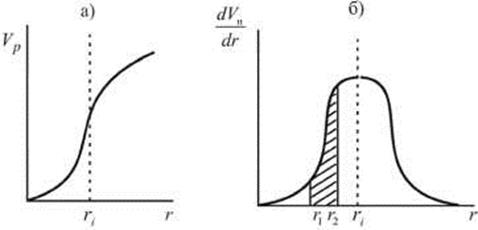
Рис. 28.8. Интегральная (а) и дифференциальная (б) кривые распределения
По дифференциальной кривой легко определить относительную долю пор любых размеров в данном пористом теле (то есть объем конкретной фракции пор). Например, площадь заштрихованного участка определяет объем пор, размеры которых лежат в пределах от r1 до r2. Чем резче выражен максимум и чем уже дифференциальная кривая, тем меньше различаются поры по размерам.