Содержание
Введение
1. Классы фотосенсибилизаторов
История создания ФДТ
Классы фотосенсибилизаторов
Хлорины
Бактериохлорины
Фталоцианины
. Средства целевой доставки фотосенсибилизаторов
2.1Внутриклеточная локализация фотосенсибилизаторов
2.2 Мишени для фотосенсибилизаторов
Внутриклеточные мишени для фотосенсибилизаторов
Источники света для ФДТ
2.5 Направленная доставка фотосенсибилизаторов
Заключение
Список литературы
Введение
Актуальность темы. В настоящее время в связи с увеличение уровня загрязнения атмосферы, почвенных покровов и водоёмов, также усилением антропогенного воздействия и нарастающими темпами деградации растительного покрова повышают значимость проблемы охраны окружающей среды и природных экосистем. Эта проблема стала одной из наиболее важных глобальных проблем современности, так как быстрые темпы загрязнения окружающей среды оказывают непосредственное воздействие на здоровье человека. В связи с резким увеличением в г. Калининграде численности людей с онкологическими заболеваниями наиболее остро встал вопрос о поиске новых прогрессивных методов терапии.
Применение традиционной и интраоперационной ФДТ явилось эффективным компонентом комбинированного лечения злокачественных новообразований, существенно улучшающим качество, а в ряде случаев и продолжительность жизни больных.
Злокачественные новообразования остаются одной из острейших медико-социальных проблем. Онкологическая заболеваемость в России неуклонно растет. Контингент больных со злокачественными опухолями составляет более 2 млн. человек т.е. 1,4% населения страны. Особую сложность представляет оказание помощи больным, не подлежащим радикальному лечению из-за распространенности опухолевого процесса или при неэффективности проводимой терапии. Учитывая, что эта группа включает четыре пятых выявленных онкологических больных, вопросы оказания реальной помощи тысячам и тысячам пациентов и членам их семей вырастают в серьезную медицинскую, социальную и гуманитарную проблему.
Не будет преувеличением утверждать, что в решении этой задачи одно из ведущих мест в современной онкологии заняла лазерная терапия и хирургия - одна из наиболее наукоемких, перспективных и, как показал клинический опыт, эффективных отраслей медицинской науки [1, 2, 3].
Одним из самых замечательных достижений фундаментальной и прикладной физики второй половины двадцатого века было открытие явлений, послуживших основой для создания оптического квантового генератора, или лазера.
Помимо двух достаточно хорошо изученных и широко используемых в клинической практике направлений применения лазеров - низкоинтенсивного стимулирующего лазерного излучения и высокоэнергетического повреждающего излучения, быстрыми темпами развивается третье направление - фотодинамическая терапия опухолей (ФДТ). Интерес к ней обусловлен тем, что разрушение опухоли достигается при облучении ее низкоинтенсивным лазерным излучением, исключающим опасность неконтролируемого термического повреждения стенки органа.
Цель работы. Поиск новых сенсибилизаторов для фотодинамической терапии, основанных на экстрактах и маслах растений калининградской области.
Задачи данного исследования. Прежде всего - поиск растений, являющихся источниками фотосенсибилизаторов, разработка средств и способов доставки полученных препаратов к мишеням (опухолевым клеткам) и подбор культур раковых клеток человека, наиболее чувствительных к этим экстрактам.
Классы фотосенсибилизаторов
История создания ФДТ
Фотодинамическая терапия (ФДТ) - часть фотохимиотерапии, при которой помимо света и препарата необходим кислород. Механизмы цитотоксичного действия ФДТ были детально показаны в работах T.J.Dougherty и соавт. [10, 11] и представить их можно следующим образом. Введенные в организм молекулы фотосенсибилизатора избирательно фиксируются на мембранах опухолевых клеток и митохондриях. Причем, максимальная концентрация препарата в тканях достигается через 24-72 часа. При облучении фотосенсибилизированной опухолевой ткани лазерным излучением происходит переход нетоксичного триплетного кислорода (IIIO2) в синглетный (IO2) кислород, обладающий выраженным цитотоксичным действием, что приводит к разрушению клеточных мембран опухолевых клеток. Синглетный кислород, несмотря на короткое время действия, успевает полностью разрушить опухолевые клетки. При этом цитотоксический эффект зависит от концентрации фотосенсибилизатора, глубины проникновения света в ткани опухоли.
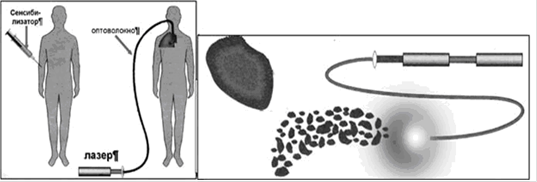
Рис. 1. Схема выполнения фотодинамической терапии.
Хотя концентрация фотосенсибилизатора в нормальных тканях низкая, в течение нескольких недель может наблюдаться их повышенная чувствительность к солнечному свету.

Рис. 2. Н. Р. Финсен - основатель фотодинамической терапии
До конца девятнадцатого века фототерапия все еще находилась на стадии становления. Первые научные исследования в области медицинского применения света были сделаны в Копенгагене датским физиком Н. Р. Финсеном (рис. 2).
Самым важным его открытием стала возможность применения солнечного света или света, получаемого от угольной дуги, для лечения туберкулезной волчанки (туберкулезного поражения кожи). Это открытие получило широкое признание. В Копенгагене был основан названный в честь Финсена Институт Медицинского Света, а в 1903 году автору изобретения была вручена Нобелевская премия за его работы по фототерапии. С тех пор он заслуженно считается основателем этой дисциплины.
В 30-х годах прошлого века Kautsky (Kautsky и de Bruijn, 1931; Kautsky et al., 1933; Kautsky, 1939) провел очень простые и элегантные эксперименты, показав, что оксидант, участвующий в реакции фотооксигенации, может быть газообразен. По мнению Kautsky возбужденный фотосенсибилизатор переводит молекулу кислорода в активное состояние. Запись этого объяснения в сегодняшней нотации будет выглядеть так:

где, С0 - основное синглетное состояние сенсибилизатора; С1 - первое возбужденное синглетное состояние; Т1 - первое возбужденное триплетное состояние; isc (intersystem crossing) - внутрисистемный перенос; 3О2 - двухатомный триплетный кислород в основном состоянии; 1О2 - первое синглетное возбужденное состояние двухатомного кислорода.
Много позже гипотеза Kautsky, по какой-то причине не принимавшаяся на протяжении 30 лет, была подтверждена и названа механизмом фотооксигенации - тип II (10). Таким образом, механизм фототоксичности второго типа связан с образованием синглетного кислорода. Считается, что 90 % ФДТ реализуется по этому пути.
Наряду с этим, хотя и в меньшей степени, фотоцитотоксичность при ФДТ реализуется по механизму первого типа, обусловленному образованием в клетке-мишени других форм реактивного (токсичного) кислорода, таких как пероксид-анион-радикал, прекись кислорода и особенно гидроксил-радикал.
Ряд биомолекул, входящих в состав мембран (ненасыщенные жирные кислоты, холестерин, боковые цепи a-аминокислот, таких как, триптофан, метионин и гистидин), быстро реагируют с РЕАКТИВНЫМ кислородом, а потому мембраны считаются наиболее вероятными первичными мишенями, поражение которых ведёт к повреждению и гибели клеток [10]. Синтез и испытания первого фотосенсибилизатора - производного гематопорфирина (HpD) осуществлен в 1950 г. С этого и началась новейшая история фотодинамической терапии. В последующие годы проведены многочисленные экспериментальные и клинические работы по диагностике и лечению злокачественных опухолей с помощью производных гематопорфирина [5, 6, 7, 8, 13, 17, 18, 19, 20, 22, 23, 24].
Классы фотосенсибилизаторов
Коммерческий препарат первого поколения Фотофрин (Северная Америка) представляет собой смесь, содержащую менее 20% неактивных мономеров и более 80% активных димеров и олигомеров. Время от времени на рынке появлялись другие коммерческие «очищенные» формы HpD, они включали: Фотокарцинорин (Китай), Фотосан (Германия), Фотогем (Россия) и Гематодрекс (Болгария). Преимуществами фотофрина являются простота изготовления из широко доступных веществ; бесспорная эффективность в качестве фотосенсибилизатора при ФДТ. Безусловно, HpD важен и исторически, поскольку этот препарат был первым, получившим официальное одобрение (FDA) для применения в ФДТ.
Однако этим преимуществам может быть противопоставлен целый ряд недостатков:
. HpD представляет собой очень сложную смесь, состав которой трудно воспроизвести, а при исследованиях дозовых зависимостей эффекта почти невозможно сопоставить результаты с молекулярной структурой вещества;
. фотодинамическая активность HpD весьма умеренна;
. препарат недостаточно селективен, а фотосенсибилизация нормальной кожи продолжается в течение нескольких недель;
. HpD хуже, чем в других областях спектра, поглощает в красном диапазоне (примерно при 630 нм). Вместе с тем, известно, что именно в этой части спектра излучение глубже проникает в ткани. Относительно невысокую генерацию синглетного кислорода при облучении лазером с длиной волны излучения 630 нм приходится компенсировать высокими дозами препарата и мощностью источника света. Несмотря на неоспоримые успехи использования Фотофрина для ФДТ, в начале 80-х годов уже было понятно, что этот препарат не станет средством выбора. Все это послужило основанием для активного поиска новых фотосенсибилизаторов, относящихся ко второму поколению, которым свойственны активная фармакодинамика, большая избирательность накопления в опухолевой ткани и лучшие спектральные характеристики с максимумом поглощения в диапазоне волн более 650 нм.
Со временем пришло понимание того, какие свойства важны для идеального противоопухолевого фотосенсибилизатора. Таких свойств названо 5 [6].
Во-первых, сенсибилизатор не должен быть токсичен в отсутствие освещения.
Во-вторых, сенсибилизатор должен иметь неизменный состав и, желательно, состоять из одного вещества.
В-третьих, желательно, чтобы сенсибилизатор имел высокий квантовый выход в триплетном состоянии с энергией триплета >94 кДж/моль - энергия возбуждения кислорода из основного состояния в возбуждённое синглентное.
Наконец, препарат должен иметь выраженное поглощение в красной части видимого спектра, поскольку именно такой свет лучше всего проникает в ткани.
Этот класс фотосенсибилизаторов вскоре появился и включает в себя порфирины, хлорины, бензопорфирины, фталоцианины и нафталоцианины.
Ниже приводятся краткие характеристики основных фотосенсибилизаторов. Для более подробного обзора следует обратиться к Bonnett [6]. Наиболее изучен из этой группы хлорин [23].
Хлорины
В отличие от порфиринов хлорины сильно абсорбируют в красной области спектра. Им было посвящено множество исследований по ФДТ. Хлориновые фотосенсибилизаторы получаются двумя путями: модификацией хлорофилла-a и химическим синтезом. На сегодня далеко продвинулись клинические испытания этого фотосенсибилизатора в качестве препарата для применения при раке верхних отделов дыхательной системы и пищеварительного тракта (Scotia QuantaNova plc.). На сходном этапе находятся еще два препарата: производное бензопорфирина (Вертепорфин: QLT PhotoTherapeutics Inc) и комплекс олова с этиопурпурином. Первое из этих веществ особенно интересно тем, что требует короткого интервала между введением препарата и облучением, приводя к слабой общей фотосенсибилизации. В ходе поиска и совершенствования, используемых для ФДТ фотосенсибилизаторов, в России был получен препарат из группы хлоринов, названный Фотодитазин.
Бактериохлорины
У бактериохлоринов наблюдается сдвиг пика поглощения в красную область. Эти вещества естественного (из бактериохлорофилла) и синтетического происхождения (например, m-THPBC). m-THPBC готовится к коммерческому применению (Scotia QuantaNova plc).
фотодинамический терапия растение клетка
Фталоцианины
Эти вещества (и родственные им нафталоцианины) активно поглощают в красном спектре. Однако они чрезвычайно гидрофобны. Комплекс фталоцианина с цинком оказался биологически активным, но для доставки требуется приготовление липосомного препарата. Фталоцианины можно сделать гидрофильными путем сульфатирования.Описан первый опыт применения сульфатированного фталоцианина алюминия («Photosens») [25]. Одной из наиболее интересных разработок было создание препарата, превращающегося в эндогенный протопорфирин, являющегося фотосенсибилизатором. Идея заключалась в использовании d-миноливулиновой кислоты (предшественника активного препарата, применяемого перорально, инъекционно или местно в виде лосьона). Поскольку это вещество находится в цепи биосинтеза гема после точек обратных связей, то при введении этого препарата можно заставить нормальный аппарат биосинтеза гема продуцировать порфирин (преимущественно протопорфирин [15]. Эта очень элегантная идея привлекает всё большее внимание.