Распространенность.
Во Вселенной.
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %. Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы.
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент.
Получение.
I. В промышленности.
1. Конверсия с водяным паром при 1000 °C:
{\displaystyle {\mathsf {CH_{4}+H_{2}O\ \rightleftarrows {}\ CO+3H_{2}}}}СН4 + Н2О↔ СО + 3Н2
2. Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
{\displaystyle {\mathsf {H_{2}O+C\ \rightleftarrows {}\ CO\uparrow +H_{2}\uparrow }}}Н2О + С↔ СО↑ + Н2↑
3. Электролиз водных растворов солей:
2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑
| 4ē |
{\displaystyle {\ce {2H2O ->[4e^{-}] 2H2 ^ + O2 ^}}}2H2O → 2H2↑ + O2↑
Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок.
5. Каталитическое окисление кислородом:
2CH4 + O2 ↔ 2CO + 4H2{\displaystyle {\mathsf {2CH_{4}+O_{2}\rightleftarrows {}\ 2CO+4H_{2}}}}
6. Крекинг и риформинг углеводородов в процессе переработки нефти.
II. В лаборатории.
1. Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:
Zn + H2SO4 → ZnSO4 + H2↑
В лабораторных условиях применяют специальные приборы:

|
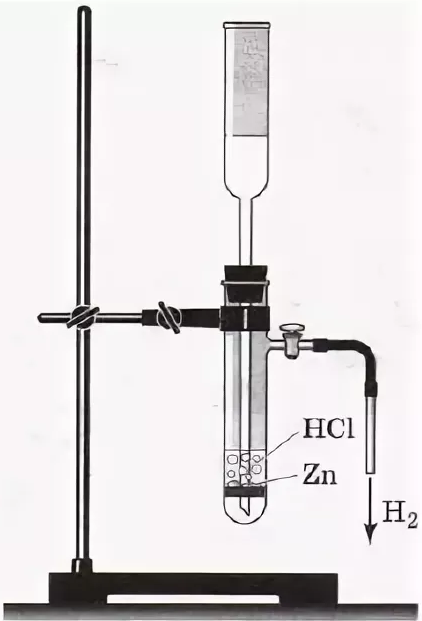
|
или его маленький аналог - прибор Кирюшкина:
{\displaystyle {\mathsf {Zn+H_{2}SO_{4}\rightarrow ZnSO_{4}+H_{2}\uparrow }}}
2. Взаимодействие кальция с водой:
Ca + 2H2O → Ca(OH)2 + H2↑{\displaystyle {\mathsf {Ca+2H_{2}O\rightarrow Ca(OH)_{2}+H_{2}\uparrow }}}
3. Гидролиз гидридов:
NaH + H2O → NaOH + H2↑{\displaystyle {\mathsf {NaH+H_{2}O\rightarrow NaOH+H_{2}\uparrow }}}
4. Действие щелочей на цинк или алюминий:
{\displaystyle {\mathsf {Zn+2KOH+2H_{2}O\rightarrow K_{2}[Zn(OH)_{4}]+H_{2}\uparrow }}}2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5. С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода.
Проверка водорода на чистоту.
Чтобы собрать водород в пробирку, нужно перевернуть ее вверх дном, потому что водород – легче воздуха и стремится вверх.

Водород почти нерастворим в воде, поэтому его можно собирать и способом вытеснения из воды.
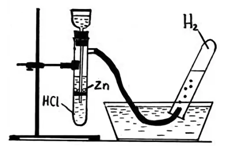
В пробирке накапливается водород, но в ней также есть и воздух, а значит и кислород. Водород и кислород – взрывоопасная смесь. Чтобы проверить полученный водород на чистоту (как проверить водород на чистоту), необходимо его поджечь с помощью тлеющей лучинки. Вы услышите хлопок. Чем звук хлопка тише, тем чище водород (меньше кислорода находится в пробирке).
Физические свойства.
Н2 — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, малорастворим в воде.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Твёрдый водород, температура плавления −259,2 °C.
Изотопы водорода.
Водород в природе встречается в виде трёх изотопов, которые имеют индивидуальные названия и химические символы: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T; радиоактивный).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 года.
Химические свойства.
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия. Поэтому при обычных температурах водород реагирует только с очень активными металлами и фтором.
Взаимодействие с активными металлалами (щелочными и щелочно-земельными).
2Na + H2 = 2NaH (гидрид натрия)
Са + Н2 = СаН2 (гидрид кальция)
Mg + Н2 = MgН2 (гидрид магния)
Гидриды - солеподобные, твердые вещества, легко гидролизуются:
СаН2 + 2Н2О = Са(ОН)2 + 2Н2↑