I. Строение атома.

Fe+2, Fe+3 - основные степени окисления
Fe+6 - очень редко, в солях железной кислоты (K2FeO4)
II. Физические свойства.
Fe - металл серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Железо относится к умеренно тугоплавким металлам. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
III. Химические свойства.
Железо относится к металлам средней активности.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующей дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
1. Взаимодействие с кислородом.
Железо горит в кислороде, нагретое горит на воздухе.
| 150 - 600°C |
3Fe + 2O2 → Fe3O4
| t |
2Fe + O2 → 2FeO
| t |
Fe + S → FeS
3. Взаимодействие с углеродом.
Fe + C → Fe3C (карбид железа)
4. Взаимодействие с азотом.
| t |
5. Взаимодействие с хлором.
| t |
| t |
3Fe + 4H2O → Fe3O4 + 4H2↑
7. Взаимодействие с кислотами.
Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4(разб) = FeSO4 + H2↑
8. Особенности взаимодействия железа с концентрированными H2SO4 и HNO3.
| t |
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2↑ + 6H2O
Fe + HNO3 (конц)→ пассивирует
С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Fe + 4HNO3 (разб) = Fe(NO3)3 + NO↑ +2H2O
5Fe + 12HNO3 (оч. разб) = 5Fe(NO3)2 + N2↑ + 6H2O
4Fe + 10HNO3 (оч. разб) = 4Fe(NO3)2 + NН4NO3↑ + 3H2O
9. Взаимодействие с растворами солей - железо способно восстанавливать металлы, стоящие в ряду активности правее него.
Fe + CuSO4 = FeSO4 + Cu
10. Железо восстанавливает соединения железа (III):
Fe + 2FeCl3 = 3FeCl2
11. Железо, при повышенном давлении, реагирует с несолеобразующим оксидом – СО с образованием веществ сложного состава – карбонилов — Fe(CO)5, Fe2(CO)9 и Fe3(CO)12.
IV. Получение железа
Основной способ получения железа – из железной руды (гематит (Fe2O3), магнетит (FeO·Fe2O3)) или электролиз растворов его солей (в этом случае получают «чистое» железо, т.е. железо без примесей).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Химизм доменного процесса следующий:
C + O2 = CO2,
CO2 + C = 2CO.
3Fe2O3 + CO = 2Fe3O4 + CO2,
Fe3O4 + CO = 3FeO + CO2,
FeO + CO = Fe + CO2.
V. Характерные степени окисления железа.
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
| +2 | FeO | Fe(OH)2 | Слабоосновный | Слабый восстановитель |
| +3 | Fe2O3 | Fe(OH)3 | Очень слабое основание, иногда — амфотерный | Слабый окислитель |
| +6 | Не получен | <H2FeO4>* | Кислотный | Сильный окислитель |
* Кислота в свободном виде не существует — получены только её соли.
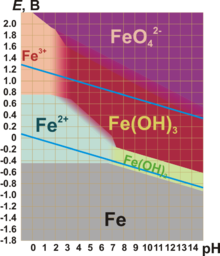
Для железа характерны степени окисления — +2 и +3.
Соединения Fe+2.
FeO - основный оксид черного цвета, в воде не растворим, растворим в к кислотах, бурый железняк.
FeO + 2HCl → FeCl2 + H2O
FeO + H2SO4 (разб)= FeSO4 + H2O
FeO + 4HNO3(конц) → Fe(NO3)3 + NO2 + 2H2O
При взаимодействии с водородом при температуре 350оС и коксом при температуре выше 1000оС восстанавливается до чистого железа.
FeO + H2 → Fe + H2O
FeO +C → Fe + CO
Получают оксид железа (II) разными способами:
1. В результате реакции восстановления оксида трёхвалентного железа угарным газом.
Fe2O3 + CO → 2FeO + CO2
2. Нагревая железо при низком давлении кислорода
2Fe + O2 → 2FeO
3. Разлагая оксалат двухвалентного железа в вакууме
FeC2O4 → FeO +CO ↑ + CO2 ↑
4. Взаимодействием железа с оксидами железа при температуре 900-1000о
Fe + Fe2O3 → 3FeO
Fe + Fe3O4 → 4FeO
Fe(OH)2 - кристаллическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде. При нагревании разлагается.
1. Взаимодействие с кислотами.
Fe(OH)2 + 2HCl = FeCl2 + H2O
2. При нагревании реагирует с концентрированными растворами солей аммония
Fe(OH)2 + 2NH4Cl = FeCl2 + 2NH3↑ + 2H2O
| 150 - 200°C |
Fe(OH)2 → FeO + H2O
4. Fe(OH)2 не устойчив, легко окисляется.
Fe(OH)2 + О2 + 2Н2О → Fe(OH)3↓
желто-коричневого цвета
Получение Fe(OH)2.
1. В виде осадка в обменных реакциях растворов солей железа(II) со щёлочью
FeSO4 + 2KOH = K2SO4 + Fe(OH)2↓
2. Образование гидроксида железа(II) является одной из стадий ржавления железа:
2Fe + 2H2O + O2 → 2Fe(OH)2
Качественные реакции на Fe+2
1. Pеакция с красной кровяной солью ( гексацианоферрат калия K3[Fe(CN)6]).
2 К3[Fe(CN)6 ] +3Fe SO4 = KFe[Fe(CN)6])↓ + 3K2SO4
темно-синий осадок
турнбуллева синь (гексацианоферрат (II) железа (III) - калия)
Появление турнбуллевой сини доказывает присутствие в растворе ионов железа (II).
2. Pеакция со щелочью.
FeSO4 +2NaOH = Fe(OH)2 ↓ + Na2 SO4
серо-зеленого цвета
Соединения Fe+3.
Fe2O3 - оксид, проявляющий слабоамфотерные свойства, порошок бурого цвета, в воде не растворим. В природе встречается как минерал гематит.
Fe2O3 имеет и другие названия: окись железа, железный сурик, крокус, пигмент красный 101, пищевой краситель E172.
Может взаимодействовать как с кислотами, так и со щелочами.
1. Взаимодействие с кислотами.
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
2. Взаимодействие со щелочами.
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
феррит натрия
3. Взаимодействие с солями щелочных металлов.
Fe2O3 + Na2СO3 → 2NaFeO2 + СO2↑
4. При температуре выше 1400°С разлагается:
6Fe2O3 = 4Fe3O4 + O2
Получение Fe2O3.
1. Термическое разложение гидроксида железа (III)
2Fe(OH)3 = Fe2O3 + 3H2O
2. Окисление пирита
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Fe(OH)3 - образуется в виде осадка, называемым ржавчиной коричнево-бурого цвета, слабоамфотерный гидроксид с преобладанием основных свойств. В воде нерастворим. Легко образует коллоидные растворы.
1. Взаимодействие с кислотами.
2Fe(OH)3 + 6HCl → 2FeCl3 + 6H2O
2. Взаимодействие с концентрированными растворами щелочей.
Fe(OH)3 + 3NaOH → Na3[Fe(OH)6]
гексагидроксоферрат (III) натрия
При сплавлении со щелочами или щелочными реагентами образует ферриты:
Fe(OH)3 + NaOH = NaFeO2 + 2H2O,
2Fe(OH)3 + Na2CO3 = 2NaFeO2 + CO2 + 3H2O
3. При нагревании разлагается:
Fe(OH)3 = FeO(OH) + H2O,
2FeO(OH) = Fe2O3 + H2O
Получение Fe(OH)3.
1. FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl
2. 4Fe + 6H2O + 3O2 → 4Fe(OH)3
3. Fe(OH)2 + О2 + 2Н2О → Fe(OH)3↓
Соли железа (III).
Железо (III) образует соли практически со многими анионами.
В растворе соли железа (III) значительно более устойчивы, чем соли железа (II). Растворы солей имеют желто-бурую окраску и, вследствие гидролиза, кислую среду:
Fe3+ + H2O = FeOH2+ + H+.
Соли железа (III) гидролизуют в большей степени, чем соли железа (II), по этой причине соли железа (III) и слабых кислот нельзя выделить из раствора, они мгновенно гидролизуют с образованием гидроксида железа (III):
Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4.
Проявляют все свойства солей.
Обладают преимущественно окислительными свойствами:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
Качественные реакции на Fe3+
1. Взаимодействие с гексацианоферратом (II) калия (желтой кровяной солью):
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl
осадок синего цвета
берлинская лазурь (гексацианоферрат (III) железа (II) - калия)
2. Взаимодействие солей железа (III) с роданидом калия или аммония:
FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl
роданид железа(III)
кроваво-красного цвета
Но стоит только к кроваво-красному раствору роданида железа добавить раствор фторида натрия, как он становится совершенно бесцветным. Образуется очень прочный комплексный ион [FeF6] 3-, при этом роданидный комплекс разрушается:
[Fe(SCN)3] + 6F- = [FeF6] 3- + 3SCN-
Реакция со щелочью.
FeCl3 + 3 NaOH = Fe(OH)3↓+ 3 NaCl
бурого цвета
Fe3O4 (FeO•Fe2O3) - оксид железа (II, III)
В природе встречается как минерал магнетит, или магнитный железняк. Он является хорошим проводником электрического тока и обладает магнитными свойствами. Образуется при горении железа и при действии перегретого пара на железо.
3Fe + 2O2 → Fe3O4
3Fe + 4H2O → Fe3O4 + 4H2
1. Нагревание при температуре 1538оС приводит к его распаду
2Fe3O4 → 6FeO + O2
2. Вступает в реакцию с кислотами
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2↑ + 5H2O
3. Со щелочами реагирует при сплавлении
Fe3O4 + 14NaOH → Na3FeO3 + 2Na5FeO4 + 7H2O
4. Вступает в реакцию с кислородом воздуха
4Fe3O4 + O2 → 6Fe2O3
5. Восстановление происходит при реакции с водородом и монооксидом углерода
Fe3O4 + 4H2 → 3Fe + 4H2O
Fe3O4 + 4CO → 3Fe +4CO2
Соединения Fe+6.
K2FeO4, Na2FeO4, MgFeO4 и др. - соли железной кислоты (H2FeO4).
H2FeO4 в свободном состоянии не существует.