Под идеальным газом понимают воображаемый газ, в котором отсутствуют силы притяжения между молекулами, а собственный объем молекул исчезающе мал по сравнению с объемом междумолекулярного пространства. Таким образом молекулы идеального газа принимаются за материальные точки. В действительно существующих газах при высоких температурах и малых давлениях можно пренебречь силами притяжения объемом самих молекул. Поэтому такие газы можно также считать идеальными.
В тех газах, которые находятся в состояниях, достаточно близких к сжижению, нельзя пренебречь силами притяжения между молекулами и объемом последних. Такие газы нельзя отнести к идеальным, и их называют реальными газами.
Основное уравнение кинетической теории газов имеет следующий вид:
p = 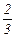 n
n 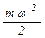 (2.1)
(2.1)
где p – давление идеального газа;
n – число молекул в 1 м3 газа (концентрация молекул);
m – масса одной молекулы;
w – так называемая средняя квадратичная скорость поступательного движения молекул.
Выражение 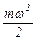 есть средняя кинетическая энергия поступательного движения одной молекулы.
есть средняя кинетическая энергия поступательного движения одной молекулы.
Таким образом, уравнение (2.1) устанавливает связь между давлением газа, средней кинетической энергией поступательного движения молекул и их концентрацией.
Основные зависимости, характеризующие соотношение между параметрами идеального газа при некоторых вполне определенных условиях изменения его состояния, легко получаются из основного уравнения кинетической теории газов. До этого они были получены экспериментальным путем.
Так, если температура газа не изменяется (Т = const), то давление газа и его удельный объем связаны следующей зависимостью (закон Бойля-Мариотта):
pu = const (2.2)
Если давление газа остается постоянным (p = const), то соотношение между удельным объемом газа и его абсолютной температурой подчиняется закону Гей-Люссака:
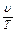 = const (2.3)
= const (2.3)
или:
рТ = const (2.4)
Для газов, взятых при одинаковых температурах и давлениях, имеет место следующая зависимость, полученная на основе закона Авогадро:
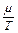 = const (2.5)
= const (2.5)
где m – молекулярная масса газа.
Так как:
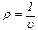
то:
mu = const (2.6)
Величина mu представляет собой объем киломоля (кмоль) газа. Для нормальных условий (t = 0°C, p = 760 мм рт.cт.) объем 1 кмоля всех идеальных газов равен 22,4136 м3/кмоль (округленно 22,4 м3/кмоль).
Плотность газа при нормальных условиях определяется из равенства:
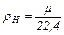 кг/м3 (2.7)
кг/м3 (2.7)
Пользуясь этой формулой, можно определить удельный объем любого газа при нормальных условиях:
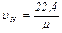 м3/кг (2.8)
м3/кг (2.8)
Характеристическое уравнение идеального газа или уравнение состояния связывает между собой основные параметры состояния – давление, объем, температуру - и может быть представлена следующими уравнениями:
рV = MRT (2.9)
рu = RT (2.10)
pVm= mRT (2.11)
В уравнениях (2.9) – (2.11) приняты следующие обозначения:
р – давление газа в Па;
V – объем газа в м3;
М – масса газа в кг;
u – удельный объем газа в м3/кг;
Vm – объем 1 кмоль газа в м3/кмоль;
R – газовая постоянная для 1 кг газа в Дж/(кг·K);
mR – универсальная газовая постоянная 1 кмоля газа в Дж/(кмоль·К)
Каждое из этих уравнений отличается от другого лишь тем, что относится к различным массам газа: первое – к М кг; второе – к 1 кг, третье – 1 кмоль газа.
Численное значение mR легко получить из уравнения (2.11) при подстановке значений входящих в него величин при нормальных условиях:
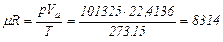 Дж/(кмоль·град)
Дж/(кмоль·град)
Газовая постоянная, отнесенная к 1 кг газа, определяется из уравнения:
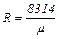 Дж/(кг·град) (2.12)
Дж/(кг·град) (2.12)
где m - масса 1 кмоль газа в кг (числено равная молекулярной массе газа).
Пользуясь характеристическим уравнением для двух различных состояний какого-либо газа, можно получить выражение для определения любого параметра при переходе от одного состояния к другому, если значения остальных параметров известны:
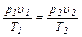 (2.13)
(2.13)
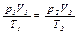 (2.14)
(2.14)
Уравнение (2.14) часто применяют для «приведения объема к нормальным условиям», так как для определения объема, занимаемого газом, при t =0°C и p =760 мм рт.ст., если объем его при каких-либо значениях p и t известен. Для этого случая уравнение (2.14) обычно представляют в следующем виде:
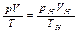 (2.15)
(2.15)
В правой части уравнения все величины взяты при нормальных условиях, в левой - при произвольных значениях давления и температуры.
Уравнение (2.13) можно записать следующим образом:
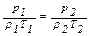
следовательно,
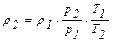 (2.16)
(2.16)
Уравнение (2.16) позволяет определить плотность газа при любых условиях, если значение его для определенных условий известно.
ЗАДАЧИ
2.1.(37) Плотность воздуха при нормальных условиях равна ρн=1,293 кг/м3. Чему равна плотность воздуха при давлении 15 бар и температуре 20°C.
ОТВЕТ: ρ = 17,83 кг/м3.
2.7.(52) Баллон с кислородом емкостью 20 л находится под давлением 10 МПа при 15°С. После израсходования части кислорода давление понизилось до 7,6 МПа, а температура упала до 10°С. Определить массу израсходованного кислорода.
РЕШЕНИЕ
Из характеристического уравнения рV = MRT имеем:
M = 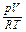
Следовательно, до расходования кислорода масса его составляла:
M1 = 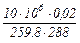 = 2,673 кг
= 2,673 кг
а после израсходования:
М2 = 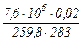 = 2,067 кг
= 2,067 кг
Таким образом, расход кислорода:
2,673 - 2,067 = 0,606 кг
2.14. Сжатый воздух в баллоне имеет температуру 15°C. Во время пожара температура воздуха в баллоне поднялась до 450°C. Взорвется ли баллон, если известно, что при этой температуре он может выдержать давление не более 9,8 МПа? Начальное давление p1=4,8 МПа.
ОТВЕТ: Да.
ГАЗОВЫЕ СМЕСИ
Состав газовой смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми или объемными долями.
Массовая доля определяется отношением массы отдельного газа, входящего в смесь, к массе всей смеси:
g1 = 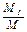 ; g2 =
; g2 = 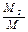 ; g3 =
; g3 = 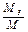 ,..., gn =
,..., gn = 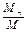
где М1, М2, М3,..., Мn - массы отдельных газов,
М - масса всей смеси.
Объемной долей газа называют отношение объема каждого компонента, входящего в смесь, к объему всей газовой смеси при условии, что объем каждого компонента отнесен к давлению и температуре смеси (приведенный объем):
r1 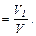 r2
r2 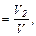 r3
r3 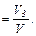
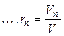
где V1,V2,V3,...,Vn - приведенные объемы компонентов газов, входящих в смесь;
V - общий объем газовой смеси.
Очевидно, что:
М1 + М2 + М3 +...+ Мn = M
g1 + g2 + g3 +...+ gn = 1
а также:
V1 + V2 + V3 +...+ Vn = V
r1 + r2 + r3 +...+ rn = 1
Для перевода массовых долей в объемные пользуются формулой:
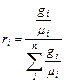 (3.1)
(3.1)
Перевод объемных долей в массовые производится по формуле:
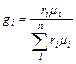 (3.2)
(3.2)
Плотность смеси определяется из выражения:
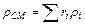 кг/м3 (3.3)
кг/м3 (3.3)
или, если известен массовый состав, по формуле:
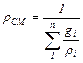 кг/м3 (3.4)
кг/м3 (3.4)
Удельный объем смеси представляет величину, обратную rСМ, поэтому, если дан объемный состав смеси, то:
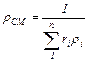 м3/кг (3.5)
м3/кг (3.5)
Если же известен массовый состав, то:
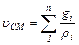 м3/кг (3.6)
м3/кг (3.6)
Из уравнения (3.3) легко получается значение так называемой кажущейся молекулярной массы газовой смеси:
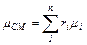 (3.7)
(3.7)
или через массовый состав:
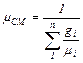 (3.8)
(3.8)
Газовую постоянную смеси газов (Rсм) можно выразить либо через газовые постоянные отдельных компонентов, входящих в смесь, либо через кажущуюся молекулярную массу смеси:
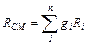 Дж/(кг·град) (3.9)
Дж/(кг·град) (3.9)
или:
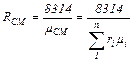 Дж/(кг·град) (3.10)
Дж/(кг·град) (3.10)
Связь между давлением газовой смеси и парциальными давлениями отдельных компонентов, входящих в смесь, устанавливается следующей зависимостью (закон Дальтона), легко получаемой из основного уравнения кинетической теории газов:
р = р1 + р2 + р3 +... +рn (3.11)
где р – общее давление газовой смеси;
р1, р2,..., р3, рn – парциальные давления отдельных компонентов, входящих в смесь.
Парциальные давления определяются проще всего, если известны объемные доли отдельных компонентов, входящих в смесь:
р1 = рr1, р2 = pr2 и т.д.
или вообще:
рi = рri, (3.12)
где рi – парциальное давление любого газа, входящего в смесь.
Если известны массовые доли, то парциальное давление любого газа, входящего в смесь, определяется из формулы:
рi 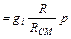 (3.13)
(3.13)
ЗАДАЧИ
3.2.(78) В 1 м3 сухого воздуха содержится примерно 0,21 м3 кислорода и 0,79 м3 азота. Определить массовый состав воздуха, его газовую постоянную и парциальные давления кислорода и азота.
ОТВЕТ: 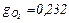 ;
; 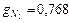 ;
;
R = 287 Дж/(кг·°C);
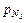 = 0,79pсм;
= 0,79pсм; 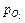 = 0,21pсм.
= 0,21pсм.
3.5.(87) Определить газовую постоянную, плотность при нормальных условиях и объемный состав смеси, если ее массовый состав следующий: Н2= 8,4%; СН4= 48,7%; С2Н4= 6,9%; СО= 17%; СО2= 7,6%; О2= 4,7%; N2= 6,7%.
ОТВЕТ: Rсм=717 Дж/(кг· °C); rO2= 0,017; rN2= 0,028; rH2= 0,484; rCO2= 0,02; ρ = 0,518 кг/м3
3.6.(90) Массовый состав смеси следующий: СО2=18%; О2=12% и N2=70%. До какого давления нужно сжать эту смесь, при t= 180 °C 8 кг ее занимали объем, равный 6 м3?
ОТВЕТ: 0,24 МПа.
3.6.(91) Определить массовый состав газовой смеси, состоящей из углекислого газа и азота, если известно, что парциальное давление углекислого газа рСО2= 1,2 бар, а давление смеси рсм= 3 бар.
ОТВЕТ: gСО2= 0,512, gN2= 0,488
ТЕПЛОЕМКОСТЬ ГАЗОВ
Теплоемкостью называют количество тепла, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо его количественной единицы на 1°С.
В зависимости от выбранной количественной единицы различают мольную теплоемкость [ mc – кДж/(кмоль·град) ], массовую теплоемкость [ с – кДж/(кг·град) ] и объемную теплоемкость [ c' – кДж/(м3·град) ].
Так как в 1 м3 газа могут содержаться, в зависимости от параметров его состояния, разные количества газа, принято относить 1 м3 газа к нормальным условиям (р=760 мм рт. ст. и t=0°C). Поэтому в дальнейшем изложении объемная теплоемкость будет относиться к массе газа, заключенной в 1 м3 его при нормальных условиях.
Для измерения количества тепла широко пользуются также внесистемной единицей тепла — килокалорией (ккал). При пользовании ею µc измеряется в ккал/(кмоль·град), с – в ккал/(кг·град) и с' – в ккал/(м3·град). Пересчет кДж в ккал и обратно производится по соотношениям:
1 ккал = 4,1868 кДж
1 кДж = 0,239 ккал
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо из них. Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость определяется из выражения:
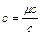 (4.1)
(4.1)
а объемная теплоемкость получается равной:
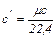 (4.2)
(4.2)
Объемная и массовая теплоемкости связаны между собой зависимостью:
c¢ =crн
где rн – плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость.
Если q – количество тепла, сообщаемого единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 (или, что то же, от Т1 до Т2), то величина:
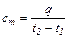 (4.3)
(4.3)
представляет собой среднюю теплоемкость в пределах t1 – t2. Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью. Аналитически последняя определяется как:
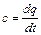
Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса. Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления.
Для газов особо важное значение имеют следующие два случая нагрева (охлаждения):
1) изменение состояния при постоянном объеме;
2) изменение состояния при постоянном давлении.
Обоим этим случаям соответствуют различные значения теплоемкостей.
Таким образом, различают истинную и среднюю теплоемкости:
а) мольную – при постоянном объеме (μcv и μcvm) и постоянном давлении (μcр и μcрm);
б) массовую – при постоянном объеме (cv и cvm) и постоянном давлении (cр и cрm);
в) объемную – при постоянном объеме (c'v и c’vm) и постоянном давлении (c'р и c’рm).
Между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость:
μcр – μcv = μR ≈ 8,314 кДж/(кмоль·К) (4.4)
Таблица 4.1
Приближенные значения мольных теплоемкостей
при постоянном объеме и постоянном давлении (с = const)
| Газы | μcv кДж. кмоль·град | μcр кДж. кмоль·град | μcv ккал. кмоль·град | μcр ккал. кмоль·град | |
| Одноатомные Двухатомные Трех -и многоатомные | 12,56 20,93 29,31 | 20,93 29,31 37,68 | 3 5 7 | 5 7 9 |
В технической термодинамике большое значение имеет отношение теплоемкостей при постоянном давлении и постоянном объеме, обозначаемая буквой k:
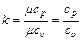
Если принять теплоемкость величиной постоянной, то на основании данных табл.4.1 получаем: для одноатомных газов k=1,67; для двухатомных газов k=1,4; для трех- и многоатомных газов k=1,29.
Теплоемкость газов изменяется с изменением температуры, причем эта зависимость имеет криволинейный характер.
Для вычисления количества тепла, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1 до t2 пользуются формулой:
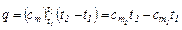 (4.5)
(4.5)
где 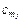 и
и 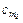 – соответственно средние теплоемкости в пределах 0° до t1 и от 0° до t2.
– соответственно средние теплоемкости в пределах 0° до t1 и от 0° до t2.
Из формулы (4.5) легко получить выражения для определения количества тепла, затрачиваемого в процессе при постоянном объеме и в процессе при постоянном давлении.
Имеем:
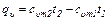 (4.6)
(4.6)
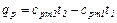 (4.7)
(4.7)
Если в процессе участвуют М кг или Vн м3 газа, то подсчет количества тепла производится по формулам:
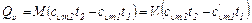 (4.8)
(4.8)
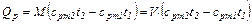 (4.9)
(4.9)
Нелинейную зависимость истинной теплоемкости от температуры представляют обычно уравнением вида:
c = a + bt + dt2
где a, b, d - величины, постоянные для данного газа.
Часто в теплотехнических расчетах нелинейную зависимость теплоемкости от температуры заменяют близкой к ней линейной зависимостью. В этом случае истинная теплоемкость определяется из уравнения:
c = a + bt
а для определения средней теплоемкости при изменении температуры от t1 до t2 пользуются уравнением:
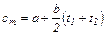
где a, b – постоянные для данного газа.
Для средней теплоемкости в пределах 0° — t эта формула принимает вид:
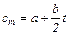 (4.10)
(4.10)
В табл. I приведены интерполяционные формулы для истинных и средних мольных теплоемкостей при постоянном давлении, а в табл. II интерполяционные формулы для массовых объемных теплоемкости при постоянном объеме.
Теплоемкость газовой смеси определяется на основании следующих формул:
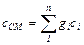 (4.11)
(4.11)
объемная теплоемкость смеси:
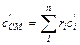 (4.12)
(4.12)
мольная теплоемкость смеси:
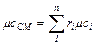 (4.13)
(4.13)
ЗАДАЧИ
4.2. (94) Определить значение массовой теплоемкости кислорода при постоянном объеме и постоянном давлении, считая с = const.
ОТВЕТ: сp =0,916 кДж/(кг·°С); сu =0,654 кДж/(кг·°С).
4.3. (95) Вычислить среднюю массовую и среднюю объемную теплоемкость окиси углерода при постоянном объеме для интервала температур 0 – 1200°С, если известно, что 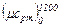 для окиси углерода равно 32,192 кДж/(кмоль·°С). Сопоставить полученные результаты с данными табл.V.
для окиси углерода равно 32,192 кДж/(кмоль·°С). Сопоставить полученные результаты с данными табл.V.
РЕШЕНИЕ
На основании формул (4.1), (4.2) и (4.4) имеем:
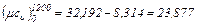 кДж/(кмоль·°С)
кДж/(кмоль·°С)
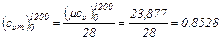 кДж/(кг·°С)
кДж/(кг·°С)
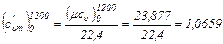 кДж/(м3·°С)
кДж/(м3·°С)
Из табл. V:
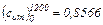 кДж/(кг·°С)
кДж/(кг·°С)
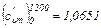 кДж/(м3·°С)
кДж/(м3·°С)
4.7. (100) Определить среднюю массовую теплоемкость при постоянном давлении cpm для кислорода в пределах от 350–1000°С:
а) считая зависимость теплоемкости от температуры нелинейной;
б) считая зависимость теплоемкости от температуры линейной.
РЕШЕНИЕ
а) Из формул (4.3), (4.7):
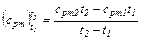
Пользуясь табл. IV, получаем для кислорода:
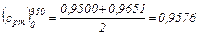 кДж/(кг·°С)
кДж/(кг·°С)
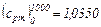 кДж/(кг·°С)
кДж/(кг·°С)
отсюда:
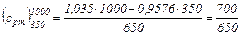 кДж / (кг·°С)
кДж / (кг·°С)
б) пользуясь табл. II и формулой (4.10), получаем:
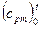 = 0,9127 + 0,00012724t
= 0,9127 + 0,00012724t
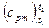 = 0,9127 + 0,00012724·(350 + 1000)= 1,085 кДж/(кг·°С)
= 0,9127 + 0,00012724·(350 + 1000)= 1,085 кДж/(кг·°С)
4.14.(113) Газовая смесь имеет следующий состав по объему: CO2=0,12; O2=0,07; N2=0,75; H2O=0,06. Определить среднюю массовую теплоемкость сpm, если смесь нагревается от 100 до 300°С.
ОТВЕТ: сpm= 1,0928 кДж/(кг·°С)=0,261 ккал(кг·°С).