Задание 1. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | |
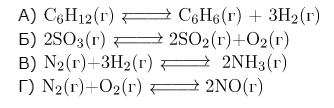
| 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
| А | Б | В | Г |
Задание 2. Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | |
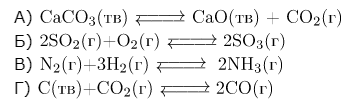
| 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) практически не смещается |
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
| А | Б | В | Г |
Задание 3. Установите соответствие между уравнением обратимой химической реакции и направлением смещения химического равновесия при охлаждении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | |
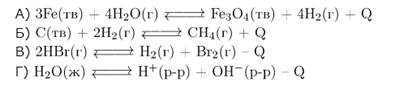
| 1) в сторону продуктов реакции 2) в сторону исходных веществ 3) положение равновесия не зависит от температуры |
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
| А | Б | В | Г |
Задание 4. Установите соответствие между способом воздействия на равновесную систему
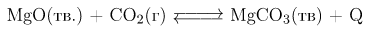
И смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | |
| А) уменьшение температуры Б) уменьшение концентрации углекислого газа В) уменьшение давления Г) добавление катализатора | 1) в сторону прямой реакции 2) в сторону обратной реакции 3) практически не смещается |
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
| А | Б | В | Г |
Задание 5. Установите соответствие между способом воздействия на равновесную систему, в которой протекает реакция 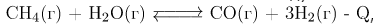 ,
,
и направлением смещения равновесия при этом воздействии.
| СПОСОБ ВОЗДЕЙСТВИЯ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ | |
| А) нагревание Б) увеличение общего давления В) добавление паров воды Г) введение катализатора | 1) смещается в направлении прямой реакции 2) смещается в направлении обратной реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| А | Б | В | Г |
Задание 6. В реактор постоянного объёма поместили некоторое количество оксида серы(IV) и кислорода. В результате протекания обратимой реакции 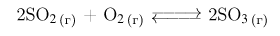
в реакционной системе установилось химическое равновесие. Используя данные, приведённые в таблице, определите равновесную концентрацию 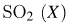 и исходную концентрацию
и исходную концентрацию 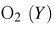 .
.
| Реагент | |||
| Исходная концентрация (моль/л) | 0,6 | ||
| Равновесная концентрация (моль/л) | 0,3 | 0,4 |
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| X | Y |
ОТВЕТЫ
Пояснение к заданию 1.
Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие сместится в сторону, ослабляющую это воздействие. Если внешним воздействием является уменьшение давления, то система будет стремиться увеличить давление, а значит, равновесие будет смещаться в сторону большего количества газообразных частиц.
А) 1 моль ↔ 4 моль, равновесие сместится в сторону продуктов реакции (1).
Б) 2 моль ↔ 3 моль, равновесие сместится в сторону продуктов реакции (1).
В) 4 моль ↔ 2 моль, равновесие сместится в сторону исходных веществ (2).
Г) 2 моль ↔ 2 моль, равновесие практически не смещается (3).
Ответ: 1123.
Пояснение к заданию 2.
Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие сместится в сторону, ослабляющую это воздействие. Если внешним воздействием является уменьшение давления, то система будет стремиться увеличить давление, а значит, равновесие будет смещаться в сторону большего количества газообразных частиц.
А) 0 моль ↔ 1 моль (учитываем только газы), равновесие сместится в сторону продуктов реакции (1).
Б) 3 моль ↔ 2моль, равновесие сместится в сторону исходных веществ (2).
В) 4 моль ↔ 2 моль, равновесие сместится в сторону исходных веществ (2).
Г) 1 моль ↔ 2 моль (учитываем только газы), равновесие сместится в сторону продуктов реакции (1).
Ответ: 1221.
Пояснение к заданию 3.
Установим соответствие.
А) 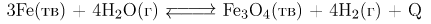 экзотермическая реакция, поэтому при охлаждении равновесие сместится вправо.
экзотермическая реакция, поэтому при охлаждении равновесие сместится вправо.
Б)  экзотермическая реакция, поэтому при охлаждении равновесие сместится вправо.
экзотермическая реакция, поэтому при охлаждении равновесие сместится вправо.
В)  эндотермическая реакция, поэтому при охлаждении равновесие сместится влево.
эндотермическая реакция, поэтому при охлаждении равновесие сместится влево.
Г)  эндотермическая реакция, поэтому при охлаждении равновесие сместится влево.
эндотермическая реакция, поэтому при охлаждении равновесие сместится влево.
Ответ: 1122.
Пояснение к заданию 4.
Это экзотермическая реакция в которой происходит уменьшение количества газообразных веществ, поэтому:
А) уменьшение температуры приведет к смещению химического равновесия в сторону прямой реакции (1).
Б) уменьшение концентрации углекислого газа приведет к смещению химического равновесия в сторону обратной реакции (2).
В) уменьшение давления приведет к смещению химического равновесия в сторону обратной реакции (2).
Г) добавление катализатора влияет лишь на скорость реакций, а не на состояние химического равновесия, поэтому практически не смещается (3).
Ответ: 1223.
Пояснение к заданию 5.
По правилу Ле-Шателье, если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные в сторону противодействия изменениям.
Если в реакции происходит поглощение тепла, то при понижении температуры равновесие смещается влево, в сторону обратной реакции. При выделении тепла наоборот. Катализаторы не влияют на положение равновесия.
Ответ: 1213.
Пояснение к заданию 6.
Так как объем системы постоянен (по условию), то количества веществ в системе пропорциональны их концентрациям. Согласно уравнению обратимой реакции:
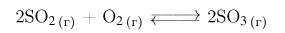
для образования 2 моль оксида серы(VI) затрачивается 2 моль оксида серы(IV) и 1 моль (в два раза меньше) кислорода. Отсюда следует, что на образование 0,4 моль оксида серы(VI) потребовалось 0,2 моль кислорода и 0,4 моль оксида серы(IV). Тогда равновесная концентрация 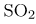 определяемая как разность исходного количества вещества и прореагировавшего (в единице объема), будет равна
определяемая как разность исходного количества вещества и прореагировавшего (в единице объема), будет равна 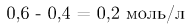 .
.
Соответственно, исходная концентрация определяется как сумма прореагировавшего количества вещества и равновесного (на единицу объема). Исходная концентрация 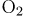 будет равна
будет равна 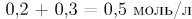
Ответ: 25.