По степени взаимодействия дисперсной фазы с дисперсионной средой.необратимые и обратимые системы.
классиф.по наличию взаимод.между частицами дисперсной фазы.
классиф.по наличию взаимод.между частицами дисперсной фазы.
По степени взаимодействия дисперсной фазы с дисперсионной средой.необратимые и обратимые системы. классиф.по наличию взаимод.между частицами дисперсной фазы. | 2.2.Строение коллоидных частиц.Пептизация. На границе раздела фаз после выделения второй самостоятельной фазы может обрадоваться электрический заряд и электронный слой. Образование такого слоя возможно тремя способами: 1)Преимущественная адсорбция одного из на поверхности твердой фазы - т.е. адсорбционный способ 2)диссоциация поверхностных молекул твердой фазы с переходом ионов определенного знака заряда в растворе,т.е. диссоционный спосо.б в 1м и 2м случаях происходит обмен зарядами между фазами. 3) Если фазы не могут обмениваться зарядами, но состоят из полярных молекул, то их взаимодействие на границе раздела фаз приводит к определенному ориентированию, т.е. ориентационной способ Пептизацию различают: 1) адсорбционная –заключается в добавлении индифферентного (не вступающего в реакцию с осадками). К свежеполученному осадку гидроксида железа добавь Fe↓+ Fe→(нет реакции) Fe= +3, где - потенциал-определяющий ион. ∙3x 2) диссолюционная – заключается в добавлении электролита, не являющегося пептизатором, но образующего пептизатор в результате химического взаимодействия с осадом. | |||
| 2.3.методов получения дисперсных систем: 1) конденсационные, основанные на достижение коллоидной степени дисперсности, путём агрегации атомов, ионов, молекул. Делятся на: -химическую и физическую конденсацию физическая конденсация: а)конденсация из паров заключается в том, что диспергируемое в-во и растворитель одновременно конденсируется на холодной поверхности; б)метод замены растворителя: истинный раствор диспергируемого вещества смешивается с жидкостью, в которой растворитель растворяется хорошо, а диспергируемое в-во плохо. В результате уменьшения его растворимости при замене растворителя, диспергируемое вещество выделяется в виде высокодисперсной фазы. химическая конденсация: основана на переводе нерастворенных веществ в растворимое состояние при помощи химических реакций различного типа, с последующей агрегацией молекул. (Пример: обмен, замедление, окисление, восстановление, и.т.п…) - нерастворимые соединения →в высокодисперсную фазу Методы диспергирования основаны на измельчения вещества до частиц коллоидных размеров. Диспергирование – комплекс двух типов: физического и химического. физическая – т.е. механическое измельчение химическое диспергирование – пептизация – перевод в раствор свежеполученных осадков. ионы или молекулы пептизатора адсорбируются на частицах коллоидного остатка и образуют двойной электрический слой и сорбатную оболочку, что приводит к преодоления сил между молекул. Сцеплению между частицами коллоидного остатка. | 3.1.Под устойчивостью коллоидных систем понимают способность сохранять своё состояние и свойства во времени. Песков показал, что следует рассматривать два вида устойчивости коллоидных систем:Кинетическую устойчивость (седиментационная) – это способность системы сохранить равномерное распределение частиц дисперсной фазы по всему объёму дисперсной среды и противостоять седиментации (оседанию). Кинетическая устойчивость определяется размером кинетически активных частиц, т.к. частицы сравнительно малых размеров участвуют в броуновском движении.Агрегатная (*) устойчивость характеризует способность системы противостоять агрегации (укрупнению) Факторы устойчивости разделяются на термодинамические и кинетические: к термодинамическим факторам относят: электростатический, адсорбционно-сорбатный, энтрофильный. К кинетическим: структурно-механический, гидрро…(*) - Электростатический фактор – участницы имеют одноименный заряд, приводящий к отталкиванию. этот фактор существует в золях и эмульсиях, стабилизированных в ионо-генными поверхностно активными веществами. - Адсорбционно-сорбатный фактор действует в лиофильных и лиофобных дисперсных системах. Изменяет природу активности дисперсной фазы, т.е. превращает эту поверхность из лиофобной в лиофильную. (родства к дисперсионной среде нет) (*). Действие его заключается в образовании толстой сорбатной оболочки, вокруг частиц, препятствующих их слипанию. Характерен для растворов высокомолекулярных соединений и для стабилизированных эмульсий. - Энтрофильный фактор обеспечивает равномерное распределение частиц дисперсионной фазы по всему объёму дисперсионной среды за счёт броуновского движения частиц. Существует в золях, где малый размер частиц не препятствует броуновскому движению и в обратных эмульсиях, стабилизированных поверхностно-активными веществами, имеющими длинные неполярные радикалы. Микроброуновское движение фрагментов радикалов способствует хаотичному распределению. | |||
3.2.Коагуляция – это потеря агрегатной устойчивости, следствием которой является слипание частиц.
Коалиценция – слияние капель жидкой фазы.
| 4.1.Молекулярно-кинетические свойства дисперсных систем
1) Броуновское движение
Как показал Эйнштейн, среднее значение квадрата смещения за промежуток времени τ определяется следующим соотношением:
2) Диффузия – самопроизвольное выравнивание частиц по всему объему раствора под действием броуновского движения. Идёт по градиенту концентрации. Количественно описывается законами Гика: -div=D∙S∙  τ, где D-коэфицент диффузии
3) Осмотическое давление
Осмос – явление проникновения частиц при разности насыщенности. Зависит от концентрации осмотически-активных частиц. Величина осмотического давления пропорциональна числу частиц растворенного вещества: τ, где D-коэфицент диффузии
3) Осмотическое давление
Осмос – явление проникновения частиц при разности насыщенности. Зависит от концентрации осмотически-активных частиц. Величина осмотического давления пропорциональна числу частиц растворенного вещества:  .
4) Седиментация – оседание коллоидных частиц под действием сил тяжести или в поле центробежных сил (что ускоряет процесс). Движение частицы в вязкой среде тормозит сила трения. При уравнении силы тяжести и силы трения оседание происходит с постоянной скоростью. .
4) Седиментация – оседание коллоидных частиц под действием сил тяжести или в поле центробежных сил (что ускоряет процесс). Движение частицы в вязкой среде тормозит сила трения. При уравнении силы тяжести и силы трения оседание происходит с постоянной скоростью.
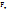 =mg=Vg =mg=Vg  = = 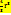 ( ( - -  )g = 6πηrU [ где U= )g = 6πηrU [ где U= 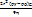
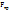 =6n =6n 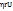 , где U –скорость оседания)(закон оседания Стокса) , где U –скорость оседания)(закон оседания Стокса)
| |||
| 4.2.Электрофорез– направленное перемещение частиц дисперсной фазы в неподвижной дисперсионной среде. Имеет большое применение и исп-ся для изучения фракционного сотава сложных биологических ситсем, очистка фармокопейных препаротов, исп-ся как метод разделения и выделения биологич.активных в-в,метод введения лечебных препаратов в организм человека, для диагностики заболевания путём сравнения фракционного состава нормальных и патогенных биологических жидкостей. Механизм электроосмоса. При контакте с водой диссоциирует поверхность, отщепление в жидкость ионов. Возникает двойной слой (диссоциированной) во внутренней обкладке входит в состав твёрдой фазы, а внешняя распределяется в жидкости. Оптические свойства коллоидных систем При падении луча на дисперсную систему нетрудно наблюдать следующие явления: 1)Прохождение света через систему 2)Преломление света частицами дисперсной фазы 3)отражение света частицами дисперсной фазы 4) рассеяние света частицами в виде опалесценций 5) адсорбция света диспергированной фазой с превращением световой энергии в тепловую Конус Тиндаля-золи способны рассеивать свет, в результате чего наблюдается конус Тиндаля, отсутствующий при прохождении светового луча через сосуд с истинным раствором, т.к. в золях присутствует процесс дифракции, их частицы существенно больше, чем в истинном растворе | 4.3.Ультра микроскопия электрического микроскопа
УМ – это наблюдение взвешенных частиц при помощи микроскопа на тёмном фоне при фокусированном падении на них сбоку света.
1) луч света
2)отражающее зеркало
3)фокусирующая линза
4)предметное стекло
5)окуляр микроскопа
Электронная микроскопия
- Вместо света используется поток быстрых электронов. Ход электронного пучка сходен с потоком света в обычном микроскопе. В качестве фокусирующей линзы используется элеуктростат или магнитные поля. Вместо предметного стекла – нитроцеллюлозная плёнка, на которую наносится тончайший слой исследуемого объекта. Разрешающая способность (5-10 А →5-10 ∙ 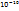 м
Ультрацентрифуга применяется для определения размера коллоидных частиц, которые под действием гравитации седиментируют очень медленно или неседименируют вообще.
Наиболее распространенными методами очистки коллоидных систем являются диализ, электродиализ и ультрафильтрация, основанные на свойстве некоторых материалов – т.н. полупроницаемых мембран (коллодия, пергамента, целлофана и т.п.) – пропускать ионы и молекулы небольших размеров и задерживать коллоидные частицы. Все полупроницаемые мембраны представляют собой пористые тела, и непроницаемость их для коллоидных частиц обусловлена тем, что коэффициент диффузии для коллоидных частиц значительно (на несколько порядков) меньше, чем для ионов и молекул, имеющих намного меньшие массу и размеры. м
Ультрацентрифуга применяется для определения размера коллоидных частиц, которые под действием гравитации седиментируют очень медленно или неседименируют вообще.
Наиболее распространенными методами очистки коллоидных систем являются диализ, электродиализ и ультрафильтрация, основанные на свойстве некоторых материалов – т.н. полупроницаемых мембран (коллодия, пергамента, целлофана и т.п.) – пропускать ионы и молекулы небольших размеров и задерживать коллоидные частицы. Все полупроницаемые мембраны представляют собой пористые тела, и непроницаемость их для коллоидных частиц обусловлена тем, что коэффициент диффузии для коллоидных частиц значительно (на несколько порядков) меньше, чем для ионов и молекул, имеющих намного меньшие массу и размеры.
| |||
| 5.1.Эмульсии - Дисперсные системы с жидкой фазой и средой. Обе жидкости нерастворимы или малорастворимые. В системе должен присутствовать эмульгатор. (различают по агрегатной устойчивости, эмульгатору, гидрофильности, гидрофобности; возвращение фаз эмульсий – аэрозоли, суспензии) Классифификация по фазе и среде: I рода (масло в воде – «прямые»), II рода (вода в масле). разбавленные эмульсии содержат до 0,1%; концентрированные 74%; высококонцентрированные (желатиниров) (*) до 95%(картинки) Агрегатная устойчивость. Эмульсии как и микрогетерогенные системы обладают избытком собственной поверхносной энергии из-за развитой мембранной поверхности => агрегатно неустойчивы. В них самостоятельно протекает процесс коалисценции, которому способствует отсутствие эмульгатора (раствор ПАВ или пераствор порошки(*) при добавлении которых эмульсия становится устойчивей). Механизм стабилизации различен; различные факторы устойчивости, возникающие при введении эмульгатора, но есть закономерность, описываемая правилом Банкрофта: Молекулы частиц эмульгатора должны располагаться на каплях дисперсной фазы в основном со стороны дисп. среды (растворение, смачивание дисперсной среды) поэтому гидрофоб-прямые (масло в воде), гидрофильные – обратные (вода в масле). Выборы эмульгатора: - он не должен допускать Расстояние между каплями > 12 мк, а значит молекула ПАВ должна содержать не менее12 ___(*) (удерживание по каплям и концентрация. Концентрация должна быть такой, чтобы на повернхности образовывался насыщенный адсорбционный слой. Эффективность: сбалансировать гидрофильное/гидрофобное. (преобладание неполяр, полярных, хорошо сбалансированных ПАВ) | 5.2.Инверсия-это переход эмульсии из прямой в обратную и наоборот.Причина инверсии- изменение природы эмульгатора, под действием небольшого количества электролита по реакции ионного обмена.
Суспензия – микрогетерогенная система с R частиц от 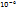 до до 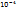 (м) фаза твёрдая| среда жидкая.
отличие от коллоидных растворов – проявляется в молекулярно-кинетических и активных свойствах: не характерны ни диффузия, ни осмос сегментация актив.
прохождение света - мутно. сегментационная устойчивость масла.
Стабилизацию проводят полимерами; действующие факторы устойчивости.
Способы получения аэрозолей
1)Диспергирование – измельчение твёрдых тел и в распылении жидкостей (тума)
Аэрозоли бывают с крупными частицами и полидисперсные
2)Конденсация – из перенасыщенных паров при наличии центра конденсации, в результате химической реакции.
Получается: высокодисперсная система с болееоднородными по размеру частицами, монодисперсными аэрозоли.
Молекулярно-кинетические свойства
Их особенности опред разностью дисперсной среды. Броуново движение, диффузия и вязкость практически отсутствуют или же выражены очень слабо. Существенное воздействие оказывает седиментация (по причине малой вязкости и плотности дисперсной среды) (м) фаза твёрдая| среда жидкая.
отличие от коллоидных растворов – проявляется в молекулярно-кинетических и активных свойствах: не характерны ни диффузия, ни осмос сегментация актив.
прохождение света - мутно. сегментационная устойчивость масла.
Стабилизацию проводят полимерами; действующие факторы устойчивости.
Способы получения аэрозолей
1)Диспергирование – измельчение твёрдых тел и в распылении жидкостей (тума)
Аэрозоли бывают с крупными частицами и полидисперсные
2)Конденсация – из перенасыщенных паров при наличии центра конденсации, в результате химической реакции.
Получается: высокодисперсная система с болееоднородными по размеру частицами, монодисперсными аэрозоли.
Молекулярно-кинетические свойства
Их особенности опред разностью дисперсной среды. Броуново движение, диффузия и вязкость практически отсутствуют или же выражены очень слабо. Существенное воздействие оказывает седиментация (по причине малой вязкости и плотности дисперсной среды)
| |||
7.1.Классификация органических соединений
По функциональным группам:
Все органические соединения делятся на классы:
Спирты – C 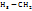 -OH
Кислоты- H-COOH
Амины – C -OH
Кислоты- H-COOH
Амины – C 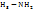 Галогено производные углеводороды - C
Галогено производные углеводороды - C 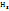 - - 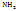 Меркаптаны- C
Меркаптаны- C 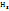 - -  Номенклатура:
Тривиальные (т.е. исторически сложившиеся, не отображающие структуру)
природный источник – сахарная кислота;
особо заметные свойства - меркаптаны – (резкий мерзкий запах);
способ получения – (пировиноградная кислота);
область применения – аскорбиновая кислота (против цинги)
Атом углерода состоит из ядра,заряд которого положительный +6(так шесть протонов), и электронной оболочки, где находится 6 электронов, расположенных на двух энергетич.уровнях. Атомы углерода в органических соединениях всегда четырехвалентны и могут находится в трех валентных состояниях
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Типы связей:гетерополярная(ионное взаимодействие), ковалентная связь, водородная связь.
Номенклатура:
Тривиальные (т.е. исторически сложившиеся, не отображающие структуру)
природный источник – сахарная кислота;
особо заметные свойства - меркаптаны – (резкий мерзкий запах);
способ получения – (пировиноградная кислота);
область применения – аскорбиновая кислота (против цинги)
Атом углерода состоит из ядра,заряд которого положительный +6(так шесть протонов), и электронной оболочки, где находится 6 электронов, расположенных на двух энергетич.уровнях. Атомы углерода в органических соединениях всегда четырехвалентны и могут находится в трех валентных состояниях
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Типы связей:гетерополярная(ионное взаимодействие), ковалентная связь, водородная связь.
| 7.2.Изомерия
Изомеры –соединения с одинаковым составом и различным порядком чередования атомов в молекуле.
Существуют следующие виды изомерии:
1) Скелетная или изомерия цепей
3) изомеры функциональных групп. Пример:
4)геометрическая изомерия:σΠ
Оптические изомеры обладают оптической активностью. Способны отклонять плосксть поляризации луча света вправо или влево от плоскостиполярицзации. Оптические отклонения сугубо индивидуальны.
Поляриметрия- Поляризатор – призма, при прохождении через которую свет становится поляризованным, т.е. вектор эл поля направлен ┴ по направлению распространения луча.
Анализатор – призма, пропускающая через себя луч, прошедший сквозь вещество поляриметрической трубки.
Электронные эффектыи
ндуктивный эффект
Виды связи: ковалентная полярная - => Сl-Cl; ковалентная неполярная=>  - - 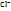 (по способу удержания
(по способу удержания  )
Электроотрицательность – способность притягивать общую электронную пару.
Ряд Полинга:
F (4)> O(3,5)> )
Электроотрицательность – способность притягивать общую электронную пару.
Ряд Полинга:
F (4)> O(3,5)> 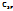 >N.Cl(3.0)>Br >N.Cl(3.0)>Br 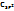 (2,8)>J(2,6)> (2,8)>J(2,6)> 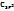 (2,5)>H(2,2)
передача электрона в (*) от заместителя по цепи σ-связей
C (2,5)>H(2,2)
передача электрона в (*) от заместителя по цепи σ-связей
C 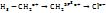 (хлор пропан) (хлор пропан) 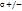 - частичный заряд
J – индуктивный эффект (+/-)
C - частичный заряд
J – индуктивный эффект (+/-)
C 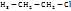 происходит смещение происходит смещение  Сl проявляется «–J» отрицательный. Если заместитель:
о↑ => электронная плотность цепи (кольца) «+J»;
если же: о↓ => электронная плотность цепи (кольца) «-J»
заместитель «с-акцептор»
Мезомерный эффект
эффект сопряжения, передача влияния заместителей по системе Π-связей.
Заместитель – участник сопряжения системы
Сопряжение системы -соединение с чередующими одинарными и двойными связями (диены) Сl проявляется «–J» отрицательный. Если заместитель:
о↑ => электронная плотность цепи (кольца) «+J»;
если же: о↓ => электронная плотность цепи (кольца) «-J»
заместитель «с-акцептор»
Мезомерный эффект
эффект сопряжения, передача влияния заместителей по системе Π-связей.
Заместитель – участник сопряжения системы
Сопряжение системы -соединение с чередующими одинарными и двойными связями (диены)
| |||
| 7.3.Кислотность и основность органических соединений. Кислотность обычно определяется по отн-ию к воде как основание, количественно она оценивается константой равновесия реакции, переноса протона от кислоты к основанию-протолитическая реакция. По теории Бренстеда кислотность и основность соединений связывается с переносом протона.Кислоты Бренстеда это нейтральные молекулы или ионы, способные отдавать протон.основание Бренстеда-это нейтральные молекулы или ионы, способные принимать протон.Чем больше величина константы кислотности, тем сильнее кислота) Сравнительный анализ силы кислоты Производят путём сравнивания стабильности сопряжённых оснований:чем стабильнее сопряжённое основание, тем сильнее кислота) Стабильность сопряжённых оснований зависит от степени дэлокации отриц.заряда, что опред-ся:1.природой атома в кислотном центре.2.хар-ром связанного с кислотным центром радикала.3.влиянием растворителя. Рассматривается электроотриц. И поляризуемость атома.чем больше электроотриц. Атома, тем больше его способность нести отриц. Заряд, тем устойчивее и как следствие кислотность выше. Поляризуемость чем она выше, т.е. рассредоточение электронного облака под действием внешних факторов, тем устойчивее образующийся анион и выше кислотность соединения.чем больше порядковый номер элемента, тем больше его поляризуемость, значит больше рассредоточение и кислотность | 7.4.Классификация органических реакций-1)по хар-ру изменения связей в субстрате и реагенте.а)радикальные-реакции, в кот. Действуют радикалы, обладающие неспаренными электронами, кот.обр-ся при гомолизе-симметричное разделение электронной пары.б)ионные-1)электрофильные-реакции, в кот. Действуют электрофильные частицы, с неполностью заполненным валентным уровнем, обладающие дефицитом электронов, при гетеролизе2)нуклеофильные-реакции, в кот. Участвуют, нуклеофильные частицы, имеющие электронную пару на внешнем электронном уровне.так же обр-ся при гетеролизе 2.в соответств. С конечным результатом1)реакции замещения S 2)реакции присоединения 3)реакции отщепления Методы исследования органич. Соединений. Для выделения и очистки соединений исп. Физико-химич. Методы:экстракция, перегонка, перекристаллизация.Для иислед. Структуры органич. Соединений исп. хромотографию и спектроскопию.Хромотография-метод разделения и очистки органич. Соединений, основанный на различном распределении в-в между подвижной фазой и неподвижной ИК спектры делятся на 4 части: а)3700-2900 см—наблюдаются полосы валентных колебаний связей атома водорода с атомами H, O, S, N, C Б) 2500-1900 область тройных связей В)1900-1300 полосы поглощения двойных связей Г)менее 1300 обусловлена колебаниями углеродного скелета молекулы которых явл-ся индивидуальной хар-кой соединения | |||
| 6. Растворы ВМС(полимеры) Ионогенные ВМС. Если звено полимерной молекулы имеет ионогенную группу, способную к образованию иона, полимерами называют полиэлектролиты. Среди них особая группа-полиамфолиты-полимеры, несущие, как + так и – зарядв живом организме. К ним относятся пептиды и белки pHсреды, при кот суммарный заряд микромолекулы =0 н-ся изоэлектрической точкой полиамфолита. Ур-е Галлера При эксперименте исследования осмотического давления р-ров ВМС в зависимости от их концентрации наблюдается отклонение от теоретической зависимости. Этот факт объясняется отн-ой независимостью теплового движения отдельных сегментов молекулы. Каждая макромолекула представляет несколько молекул меньшего размера. Для расчёта осмотического давления р-ров Галлер предложил ур-е: Из всех св-в р-ров ВМс осмотич метод наиболее чувствителен при определении молекулярной массы полимера измеряя осмотич давление р-ров ВМС различных концентраций строят зависимость: Мембранное равновесие Доннана Присутствие в организме солей белков определенных клеточной мембраной от р-ров эл-ов приводит к перераспределению эл-ов, кот подчиняются ур-ю Доннана Рассм. Живую клетку, находящуюся в р-ре низкомолекулярного эл-та. Внутри клетки нах-ся соль белка кот не может дифиндировать через клет. Мембрану При равновесии число ионов, находящихся по обе стороны мембраны должно быть одинаково. Это возможно, когда произведение концентрации этих ионов будет одинак. Калий-натриевый насос: Насос-белковый комплекс, способный избирательно присоединять транспортируемый ион. В живых клетках действует активный транспорт-это транспорт против градиента концентрации, ион связан с расходыванием энергии. К-Nа насос переносит ионы К и Натрия через мембрану клетки против градиента конц., за счёт энергии АТФ | 8.1.Арены. К ароматическим относят карбоциклические углеводороды, кот несмотря на высокую степень ненасыщенности, не обнаруживают характерных св-в непредельных соединений. Типичный представитель-бензол С6Н6 Критерии ароматичности:1)не вступают в реакции присоединения, легко осуществляющиеся в ряду алкенов, алкинов, напротив, зарактерными яв-ся реакции электрофильного замещения 2) достаточно устойчивы к действиию окислителей 3) ароматическая система обладает термодинамич устойчивостью. Изомерия и номенклатура. Общая формула бензола Сn H 2n-6 Монозамещенные бензола не имеют изомеров по положению заместителей в кольце. Дизамещённые образуют:орто-, мета- и пара- изомеры.Так же встречается изомерия боковой цепи и изомерия радикалов. При построении названия за основу принимают кольцо бензольное, которое нумеруют в соотв. С общими правилами номенклатуры для циклических систем. Направление отсчета выбирают в соотв. Со страршинством заместителей так, чтобы они получили возможно меньшие номера. Механизм электрофильного замещения Первые стадии электрофильного замещения напоминают рекцию присоединения у алкенов.Приближение электрофильного реагента Е к бензольному ядру вызывает поляризацию пи- электронного облака, в результате кот. Возникает непрочный комплекс между ядром и пи-комплексом. Даоьше ядро отдает пи-эл-ую пару, на образование связи с электрофилом. В образовавшемся комплексе один атом углерода меняет плоскостно-тригональную гибридизацию на тетраэдрическую, в ядре нарушается ароматич. Структура. Эта стадия самая медленная и определяет течение всей реакции. На последнем этапе из этого комплекса выталкивается протон, а электронная пара связи С-Н возвращается в ядро, и оно снова преобретает ароматич. Хар-р. | |||
| 8.2.Реакйии галогенирования: галогены(бром, хлор) в присутсвии железа, либо их галогенидов), замещают водород бензольного кольца на галоген без нагревания. Катализатор облегчает образование электрофильной частицы Реакция нитрования. Бензол и его гомологи нитруют смесью азотной и серной кислот в соотношении 1:2. Серная кислота как катализатор способствует образованию из азотной кислоты электрофильной частицы- катиона нитрония. Сам бензол нитруется встряхиванием с нитрующей смесью при темп. 50-60 С Реакция сульфирования.в ней обр-ся сульфокислоты ароматического ряда. Сульфирование бензола обычно проводят концентрированной серной кислотой при 100 С. Сульфирующей частицей в серной кислоте яв-ся катион сульфония Особенностью сульфирования яв-ся её обратимость. | 8.3.Правила ориентации в бензольном ядре. В бензоле все атомы углерода равноценны и электрофильный реагент с равной вероятностью атакует любое положение кольца с образованием единственного продукта замещения. В замещенном безоле взаимное влияние заметсителя и бензольного ядра приводит к тому, что электронная плотность в ядре распределяется неравномерно и атомы углерода обнаруживают различное сродство к электрофилу Е+. Если заместитель повышает электронную плотность в ядре, он облегчает взаимодействие электрофила и ядра, и скорость рекции Sе2 увеличивается.Если заместитель оттягивает электр. Плотность ядра, взаимодействие с электрофилом затрудняется и реакция замедляется. Неравномерность распределения пи-электронного облака в кольце бензольном и замещение с большей скоростью идёт по атомам углерода, обогащённым электронами, означает, что присутствующий в ядре заместитель ориентирует вступление следующего в определенные положения. Аминокисло́ты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе. Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставкаамино с указанием положения аминогруппы буквой греческого алфавита. | |||
8.4.Аминокисло́ты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
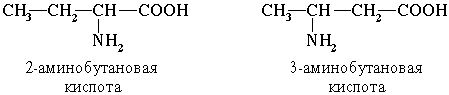 Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставкаамино с указанием положения аминогруппы буквой греческого алфавита.
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставкаамино с указанием положения аминогруппы буквой греческого алфавита.
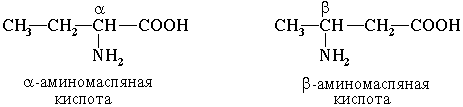 Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино, три группы NH2 – триамино и т.д.
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино, три группы NH2 – триамино и т.д. 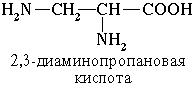
| 8.5.Изомерия аминокислот
1. Изомерия углеродного скелета 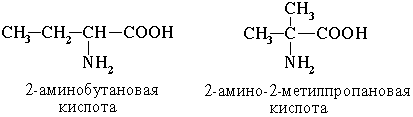 2. Изомерия положения функциональных групп
2. Изомерия положения функциональных групп
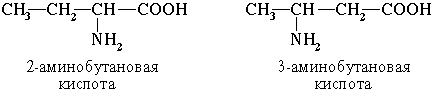 3. Оптическая изомерия.Все α-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (α-атом) и могут существовать в виде оптических изомеров (зеркальных антиподов).
3. Оптическая изомерия.Все α-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (α-атом) и могут существовать в виде оптических изомеров (зеркальных антиподов).
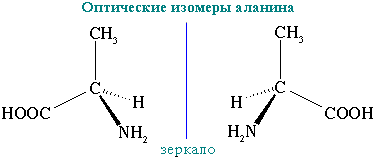 Строение аминокислот.
В каждой молекуле аминокислоты присутствует атом углерода, связанный с четырьмя заместителями. Один из них — атом водорода, второй — карбоксильная группа — СООН. От карбоксильной группы легко отделяется ион водорода Н+, благодаря чему в названии аминокислот и присутствует слово «кислота». Третий заместитель — аминогруппа — NH2. Четвертый элемент аминокислоты — группа атомов, которую в общем случае обозначают R. У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль. R-группа также называется боковая цепь.
Строение аминокислот.
В каждой молекуле аминокислоты присутствует атом углерода, связанный с четырьмя заместителями. Один из них — атом водорода, второй — карбоксильная группа — СООН. От карбоксильной группы легко отделяется ион водорода Н+, благодаря чему в названии аминокислот и присутствует слово «кислота». Третий заместитель — аминогруппа — NH2. Четвертый элемент аминокислоты — группа атомов, которую в общем случае обозначают R. У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль. R-группа также называется боковая цепь.
| |||
| 8.6.К аминокислотам отн-ся соединения, в состав кот входят амино- и карбоксильная группы В зависимости от положения аминогруппы в углеродной цепи по отношению к карбоксилу различают альфа-, бетта-, гамма- и т. д. аминокислоты. Их называют аналогично производным соответствующих карбоновых кислот, обозначая положение аминогруппы буквами греческого алфавита или цифрами. Изомерия аминокисл. Связана с положением аминогруппы и со строением углеродного скелета. Альфа-аминокислоты. Почти все содержат в молекуле ассиметричекий атом углерода и поэтому обладают оптической активностью, существуя в виде двух антиподов.Химические св-ва1) аминокислоты- амфотерные соединения. Это св-во определяется наличием в составе молекул двух функциональных групп-амино- и карбоксильной 2) альфа-амиокислоты с ионами переходных металлов образуют прочные хелатные комплексы. 3) реакции по карбоксильной группе аналогичны реакциям карбоновых кислот, которые образуют соли, сложные эфиры, амиды и т.д. 4)реакции аминогруппы аналогичны превращениям аминов, легко образуют с минеральными кислотами соли. Биологическая роль. Широко исп-ся в соременной медицине в качестве лекарственных средств. К таким аминокислотам отн-ся глутаминовая кислота(участвует в обмене белков и углеводов, способствует синтезу нейромедиатора ацетилхолина.исп-ся для лечений заболеваний нервоной системы), метионин(относится к числу незаменимых аминокислот, необходимы для поддержания роста и азотистого равновесия в организме), глицин(яв-ся нейромедиатором тормозного типа действия, улучшает метаболические процессы в мозге и оказывает положительное влияние при мышечной дистрофии.), цистеин(заменимая аминокислота.используется как средство для задержки развития катаракты и просветления хрусталика) | ||||
| 8.7.Пептиды и белки. Пептиды- природные или синтетические соединения, построенные из остатков альфа-аминокислот, соединенных между собой пептидными связями. По кол-ву аминокислотных остатков различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие в своем составе до 10 аминокислотных остатков, называют олигопептидными, более 10 – полипептидами. Полипептиды с большими молекулярными массами называют белками. Пептиды и белки яв-ся очень разнообразными соединениями, но общий принцип построения их молекул одинаков:связь между аминокислотами осуществляется за счёт взаимодействия карбоксильной группы одной аминокислоты с аминогруппой другой. Последовательность аминокислот в полипептидной цепи представляет собой первичную структуру пептида или белка. | 9.1юСвойства и функции мембран. Все клеточные мембраны представляют собой подвижные текучие структуры, поскольку молекулы липидов и белков не связаны между собой ковалентными связями и способны достаточно быстро перемещаться в плоскости мембраны. Благодаря этому мембраны могут изменять свою конфигурацию, т. е. обладают текучестью.Мембраны — структуры очень динамичные. Они быстро восстанавливаются после повреждения, а также растягиваются и сжимаются. Биологические мембраны как основные структурные элементы клетки служат не просто физическими границами, а представляют собой динамичные функциональные поверхности. На мембранах органелл осуществляются многочисленные биохимические процессы, такие как активное поглощение веществ, преобразование энергии, синтез АТФ и др. Функции биологических мембран следующие: 1. Отграничивают содержимое клетки от внешней среды и содержимое органелл от цитоплазмы. 2. Обеспечивают транспорт веществ в клетку и из нее, из цитоплазмы в органеллы и наоборот. 3. Выполняют роль рецепторов (получение и преобразование сит-налов из окружающей среды, узнавание веществ клеток и т. д.). 4. Являются катализаторами (обеспечение примембранных химических процессов). 5. Участвуют в преобразовании энергии. ри клеточных движениях. | |||
| 9.2Жидкости организма разделяют на внутриклеточную жидкость (~28 л) и внеклеточную жидкость (~14 л). Различают три вида внеклеточной жидкости: (а) межклеточная жидкость, ~11 л: жидкость межклеточных пространств различных тканей; (б) жидкость плазмы крови и лимфы, ~3 л, жидкость клеток крови относится к внутриклеточной жидкости; (в) трансцеллюлярные жидкости, ~1 ÷ 2 л: синовиальная жидкость, перитонеальная жидкость, перикардиальная жидкость, спинномозговая жидкость, жидкость внутриглазных пространств (водянистая влага глаза), перилимфа,эндолимфа, жидкости полостей тела и желудочно-кишечного тракта, жидкости секретируемые железами. Состав всех этих жидкостей существенно различается. | 9.3КровьКровь, лимфа и тканевая жидкость образуют внутреннюю среду организма, омывающую все клетки и ткани тела. Внутренняя среда имеет относительное постоянство состава и физико-химических свойств, что создает приблизительно одинаковые условия существования клеток организма (гомеостаз). Кровь - это особая жидкая ткань организма.
Функции крови1. Транспортная функция.Циркулируя по сосудам, кровь транспортирует множество соединений - среди них газы, питательные вещества и др.2. Дыхательная функция. Эта функция заключается в связывании и переносе кислорода и углекислого газа.3. Трофическая (питательная) функция. Кровь обеспечивает все клетки организма питательными веществами: глюкозой, аминокислотами, жирами, витаминами, минеральными веществами, водой.4. Экскреторная функция. Кровь уносит из тканей конечные продукты метаболизма: мочевину, мочевую кислоту и другие вещества, удаляемые из организма органами выделение.
5. Терморегуляторная функция. Кровь охлаждает внутренние органы и переносит тепло к органам теплоотдачи.6. Поддержание постоянства внутренней среды. Кровь поддерживает стабильность ряда констант организма.7. Обеспечение водно-солевого обмена. Кровь обеспечивает водно-солевой обмен между кровью и тканями. В артериальной части капилляров жидкость и соли поступают в ткани, а в венозной части капилляра возвращаются в кровь.
8. Защитная функция. Кровь выполняет защитную функцию, являясь важнейшим фактором иммунитета, или защиты организма от живых тел и генетически чуждых веществ.9. Гуморальная регуляция. Благодаря своей транспортной функции кровь обеспечивает химическое взаимодействие между всеми частями организма, т.е. гуморальную регуляцию. Кровь переносит гормоны и другие физиологически активные вещества.
Состав и количество крови
Кровь состоит из жидкой части - плазмы и взвешенных в ней клеток (форменных элементов): эритроцитов (красных кровяных телец), лейкоцитов (белых кровяных телец) и тромбоцитов (кровяных пластинок).Объем циркулирующей крови относительно постоянен, несмотря на непрерывное всасывание воды из желудка и кишечника. Это объясняется строгим балансом между поступлением и выделением воды из организма.
Вязкость кровиЕсли вязкость воды принять за единицу, то вязкость плазмы крови равна 1,7-2,2, а вязкость цельной крови - около 5. Вязкость крови обусловлена наличием белков и особенно эритроцитов, которые при своем движении преодолевают силы внешнего и внутреннего трения. Вязкость увеличивается при сгущении крови, т.е. потере воды (например, при поносах или обильном потении), а также при
Поиск по сайту©2015-2024 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование. Дата создания страницы: 2022-11-01 Нарушение авторских прав и Нарушение персональных данных |
Поиск по сайту: Читайте также: Деталирование сборочного чертежа Когда производственнику особенно важно наличие гибких производственных мощностей? Собственные движения и пространственные скорости звезд |