Для лучшего понимания процесса проводимости тока в жидкостях, можно представить следующий опыт: в ванну с дистиллированной водой поместим две металлические пластины (электроды: катод и анод), подключенные к источнику тока, в цепи в качестве индикатора тока можно взять лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит. Оказывается, раствор сахара в воде тоже ток не проводит. Но если в ванную поместить некоторое количество NaCl – поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали упорядоченно двигаться свободные носители заряда (сл.1). Упорядоченное движение заряженных частиц называется электрическим током. В металлах заряженные частицы – электроны. Какие же заряженные частицы есть в растворе?
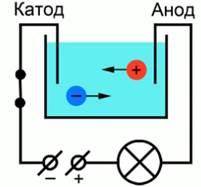
Откуда берутся свободные заряды?
Как было сказано в одном из предыдущих занятий, некоторые диэлектрики – полярные. Вода имеет как раз-таки полярные молекулы (сл. 2).
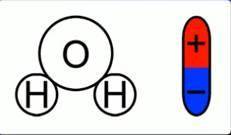
Полярность молекулы воды
При внесении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные – возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных заряженных частиц. Такие частицы называются ионами. Ион - это заряженная частица, в которую превращается атом или молекула, потеряв (присоединив) один или несколько электронов. Ион натрия имеет положительный заряд, ион хлора – отрицательный (сл. 2). Именно эти ионы и будут двигаться между электродами под действием электрического поля.
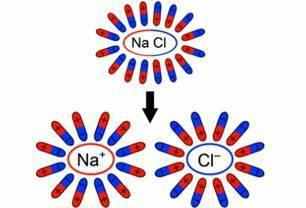
Схема образования свободных ионов
При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои.
Проводят электрический ток не только водные растворы солей, но и щелочей и кислот.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Значит, электролиты – это водные растворы солей, кислот, щелочей, а также расплавы некоторых солей и оснований, проводящие электрический ток
Носителями заряда в электролитах являются- положительные и отрицательные ионы.
Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул.
Это явление называется электролитической диссоциацией.
Итак, процесс распада электролита на ионы под действием растворителя, называется электролитической диссоциацией.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вывод: ток в электролитах - это упорядоченное движение положительных и отрицательных ионов
При прохождении электрического тока через электролит наблюдается выделение веществ, входящих в электролит, на электродах.
Электролиз - это явление выделения на электродах веществ, входящих в состав электролита, при протекании через него электрического тока.
В 1834 г. английский физик Майкл Фарадей опытным путем установил, что за определенное время ток всегда выделяет из раствора электролита одно и то же количество данного химического элемента.
Таким образом, ученый сформулировал закон, который назвали первым законом Фарадея: m = k I ∆t. Масса вещества, выделяющегося на электроде при электролизе, пропорциональна силе тока I и времени ∆t его прохождения. Если вспомнить формулы из темы о постоянном токе: I=∆q/∆t То можно представить первый закон Фарадея в виде: m = k∆q. (масса m выделившегося на электроде вещества
пропорциональна прошедшему через электролит заряду ∆q и времени ∆t прохождения тока).
m= kI∆t = k∆q.
k – электрохимический эквивалент вещества. Как вы думаете от чего он будет зависеть? В чём измеряется? 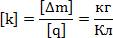
Если k зависит от вещества, где его можно найти? Откроем страницу 108 вашего учебника. Чему равен k хлора, серебра, меди?
Второй закон Фарадея непосредственно касается измерения электрохимического эквивалента через другие константы для конкретно взятого электролита:
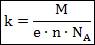
Здесь: М – молярная масса электролита (М=А*10-3кг/моль, атомная масса); е – элементарный заряд; n – валентность электролита; NA – число Авогадро.
F = eN A – постоянная Фарадея.
F = eN A = 9,65*104 Кл / моль.
Исходя из второго закона Фарадея, первый закон можно представить в виде:
 или m
или m 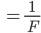
Презентация 2 «Применение электролиза на практике»
Выступление студентов
Практическая часть. Решение расчетных задач
Мы выяснили, что представляет собой электрический ток в жидкостях. Рассмотрели механизм образования свободных носителей заряда в жидкости и их дальнейшего движения, процесс электролиза: его законы и его применение в технике. Давайте проверим, как вы заполнили рабочие карточки.
Молодцы! Знать теорию мало, надо уметь применять её при решении задач. Предлагаю решить задачи из рабочих карточек, задачи расположены в порядке усложнения материала. При решении необходимо использовать все имеющиеся у вас знания. За консультацией при решении задач можно обращаться к преподавателю. Напоминаю, что для решения необходимо пользоваться таблицей электрохимических эквивалентов.
Пока идёт процесс решения задач, предлагаю, двоим желающим опытным путём определить электрохимический эквивалент меди.
Контролирующий материал
Электролиз
1) Какая из перечисленных жидкостей является электролитом?
А) Дистиллированная вода
Б) Расплавленный селен
В) Раствор кислоты
2) Выделение вещества на электроде при пропускании через электролит тока, называется……………………………………………………….
3) Как называется положительный электрод?
4) Сформулируйте 1 закон Фарадея. Запишите формулу.
Какая из перечисленных жидкостей является электролитом?
А) Раствор соли
Б) Расплавленный селен
В) Дистиллированная вода
5)Распад молекул на ионы под действием растворителя, называется…………………………………………………………………………………
6) Как называется отрицательный электрод?
7) Сформулируйте 2 закон Фарадея. Запишите формулу.
и отправьте мне в контакте https://vk.com/id300455001