Тестовые задания.
Химический эквивалент. Эквивалентное число. Фактор эквивалентности. Молярная масса эквивалента. Моль эквивалента. Закон эквивалентов. Способы выражения концентраций раствора. Теоретические основы титриметрических методов анализа. Классификация методов. Способы титрования. Расчеты в титриметрии.
1. Эквивалентное число z восстановителя в реакцииI2 + Na2S2O3 →NaI + Na2S4O6 равно
1) 1 2)2 3)1/2 4)4
2. Эквивалентное число z окислителя в реакцииI2 + Na2S2O3 →NaI + Na2S4O6 равно
1) 1 2)2 3)1/2 4)4
3. Фактор эквивалентности f ортофосфорной кислоты в реакции нейтрализации до среднейсоли равен
1) ½ 2)1/3 3)1/1 4)1/4
9. Фактор эквивалентности f ортофосфорной кислоты вреакции нейтрализации раствором гидроксида натрия с образованием дигидрофосфата натрия равен
1) ½ 2)1/3 3)1/1 4)1/4
10. Фактор эквивалентности f ортофосфорной кислоты в реакции нейтрализации раствором гидроксида натрия с образованием гидрофосфата натрия равен
1) ½ 2)1/3 3)1/1 4)1/4
11. Фактор эквивалентности f мышьяковой кислоты Н3АsO4 в реакции нейтрализации раствором гидроксида натрия с образованием дигидроарсената натрия равен
1) ½ 2)1/3 3)1/1 4)1/4
12. В реакции полной нейтрализации серная кислота имеет фактор эквивалентности f равный
1)1/3 2)1/1 3) ½ 4)4/5
13. Эквивалентное число z восстановителя в реакции FeSO4 +KMnO4 +H2SO4→Fe2(SO4)3 +K2SO4 +MnSO4 +H2Oравно
1) 1 2) 2 3) 3 4)5
14. Эквивалентное число z окислителя в реакции FeSO4 +KMnO4 +H2SO4→Fe2(SO4)3 +K2SO4 +MnSO4 +H2Oравно
1) 1 2) 2 3) 3 4)5
15. Реакция протекает по схеме K2Cr2O7 + KI + H2SO4→Cr2(SO4)3 +K2SO4 + I2 +H2O.Эквивалентное число z для окислителя равно
1) 5 2) 4 3) 6 4) 2
16. Реакция протекает по схеме K2Cr2O7 + KI + H2SO4→Cr2(SO4)3 +K2SO4 + I2 +H2O.Эквивалентное число z для восстановителя равно
1) 5 2) 4 3) 6 4) 1
17. Реакция протекает по схеме K2Cr2O7 + KI + H2SO4→Cr2(SO4)3 +K2SO4 + I2 +H2O.Фактор эквивалентности для окислителя равен
1) 1/5 2)1/ 4 3) 1/6 4) ½
18. Реакция протекает по схеме K2Cr2O7 + KI + H2SO4→Cr2(SO4)3 +K2SO4 + I2 +H2O.Фактор эквивалентности для восстановителя равен
1) 1/1 2)1/4 3) 1/6 4)1/2
19. Вычислить молярную массу эквивалента ортофосфорной кислоты в реакции образования гидрофосфата калия.
1) 98 2) 49 3) 196 4)32,66
20. Вычислить молярную массу эквивалента ортофосфорной кислоты в реакции образования дигидрофосфата калия
1) 98 2) 49 3) 196 4) 32,66
21. Вычислить молярную массу эквивалента ортофосфорной кислоты в реакции образования ортофосфата калия
1)98 2)49 3)196 4) 32,66
22. Mолярная массаэквивалента M(1/2 Na2CO3) равна
1) 105,98 2) 52,99 3) 35,33 4) 48
23. Молярная масса эквивалента M(1/3 KMnO4) равна
1) 158 2) 52,66 3) 31,6 4) 79
24. Молярная масса эквивалента М(1/2 H2SO4) равна
1) 98 2) 49 3) 196 4) 50
25. ВеществоСа(ОН)2, подвергли нейтрализации до хлорида кальция. Молярнаямасса эквивалента этого вещества имеет обозначение
1) M(1/3 Ca(OH)2) 2) M(1/2 Ca(OH)2) 3) M(1/3 Ca(OH)2) 4) M(Ca(OH)2)
26. Са(ОН)2 подвергли нейтрализации до гидроксохлорида кальция. Молярная масса эквивалента имеет обозначение
1) M(1/3 Ca(OH)2) 2) M(1/2 Ca(OH)2) 3) M(1/3 Ca(OH)2) 4) M(Ca(OH)2)
27. Молярная масса эквивалента AlCl3переведенного поддействием гидроксида натрия в тетрагидроксоалюминат натрия имеет обозначение
1) M(1/2 АlCl3) 2) M(1/3 АlCl3) 3) M(1/4 АlCl3) 4) M(АlCl3)
27. Молярная масса эквивалента AlCl3переведенного под действием гидроксида натрия в дигидроксохлорид алюминия имеет обозначение
1) M(1/2 АlCl3) 2) M(1/3 АlCl3) 3) M(1/4 АlCl3) 4) M(АlCl3)
28. Молярная масса эквивалента AlCl3переведенного под действием гидроксида натрия в гидроксохлоридалюминия имеет обозначение
1) M(1/2 АlCl3) 2) M(1/3 АlCl3) 3) M(1/4 АlCl3) 4) M(АlCl3)
29. Молярная масса эквивалента AlCl3переведенное под действием раствора гидроксида натрия в гидроксид алюминия имеет обозначение
1) M(1/2 АlCl3) 2) M(1/3 АlCl3) 3) M(1/4 АlCl3) 4) M(АlCl3)
30. Процесс окисления пероксида водорода под действием перманганата калия в сернокислой среде описывается уравнением:
H2O2 + KMnO4 + H2SO4 →MnSO4 + O2 + K2SO4 +H2O
Молярная масса эквивалента H2O2имеет вид:
1) M(1/3 H2O2) 2) M(1/4 H2O2) 3) M(1/2 H2O2) 4) M(H2O2)
30. Процесс окисления пероксида водорода под действием перманганата калия в сернокислой среде описывается уравнением:
H2O2 + KMnO4 + H2SO4 →MnSO4 + O2 + K2SO4 +H2O
Молярная масса эквивалентаперманганата калия в этом процессеимеет вид:
1) M(1/3 KMnO4) 2) M(1/4 KMnO4) 3) M(1/5 KMnO4) 4) M(KMnO4)
31. Закон эквивалентов для окислителя и восстановителя в реакции
Н2О2 + KMnO4 +H2O →MnO2+ O2+ KOH + H2O
имеет вид
1) n(1/2H2O2)=n(1/3KMnO4)
2) n(1/3H2O2)=n(1/2KMnO4)
3) n(1/5H2O2)=n(1/4KMnO4)
4) n(H2O2)=n(1/5KMnO4)
32. Закон эквивалентов для окислителя и восстановителя в реакции
KHSO3 + I2 + H2O →KHSO4 +KI
имеетвид:
1) n (KHSO3)= n (I2)
2) n (1/2KHSO3)= n (1/2I2)
3) n (1/2KHSO3)= n (I2)
4) 4) n (KHSO3)= n (1/2I2)
33. Тетраборат натрия взаимодействует раствором соляной кислоты по реакции:
Na2B4O7 + 2HCl +5H2O = 4 Н3BO3 +2NaCl
Закон эквивалентов для тетрабората натрия и соляной кислоты имеет вид:
1) n (1/2Na2B4O7)= n (1/2HCl)
2) n (Na2B4O7)= n (1/2HCl)
3) n (1/2Na2B4O7)= n (HCl)
4) n (Na2B4O7)= n (HCl)
Способы выражения концентраций растворов
1. массовая доля растворенного вещества – этоотношение
1) количества растворенного вещества к массе растворителя
2) количества растворенного вещества к массе раствора
3) массы растворенного вещества к массе раствора
4) массы растворенного вещества к массе растворителя
5) массы растворенного вещества к объему раствора
2. молярная концентрация – это отношение
1) количества растворенного вещества к массе растворителя
2) количества растворенного вещества к массе раствора
3) количества растворенного вещества к объему растворителя
4) количества растворенного вещества к объему раствора
5) массы растворенного вещества к объему раствора
3. молярная концентрация эквивалента – это отношение КОЛИЧЕСТВА ЭКВИВАЛЕНТОВ РАСТВОРЕННОГО ВЕЩЕСТВА К
1) объему растворителя
2) объему раствора
3) массе раствора
4) массе растворителя
5) количеству растворителя
4. титр растворенного вещества –отношение
1) массы растворенного вещества к массе раствора
2) массы растворенного вещества к объему раствора
3) массы растворенного вещества к объему растворителя
4) массы растворенного вещества к массе растворителя
5) количества растворенного вещества к объему раствора
5. моляльная концентрация – это отношение количества РАСТВОРЕННОГО ВЕЩЕСТВА К
1) массе раствора
2) объему раствора
3) объему растворителя
4) массе растворителя
5) количеству растворителя
6. для вычисления титра раствора нельзя использовать соотношение
1) 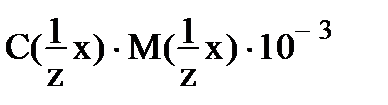
2) 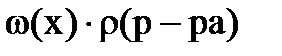
3) 
4) 
5) 
7. мольная доля – это отношение количестваРАСТВОРЕННОГО ВЕЩЕСТВА К
1) количеству растворителя
2) объему раствора
3) объему растворителя
4) массе растворителя
5) сумме количеств всех компонентов раствора
8. для вычисления молярной концентрации раствора нельзя использовать соотношение
1) 
2) 
3) 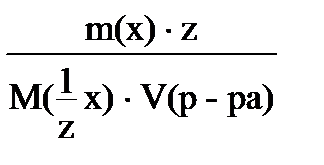
4) 
5) 
17. для вычисления молярной концентрации эквивалента нельзя использовать соотношение
1) 
2) 
3) 
4) 
5) 
18. для вычисления массовой доли раствора нельзя использовать соотношение
1) 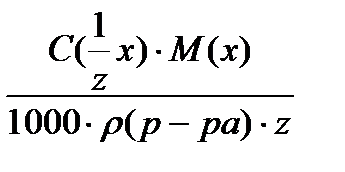
2) 
3) 
4) 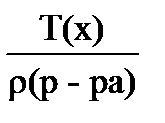
5) 
19.В мерной колбе объемом 200 мл растворили 5,85 г хлорида натрия. Молярная концентрация хлорида натрия в полученной растворе равна
1) 0,1 M 2) 0,3 M 3) 0, 5 M 4) 1M
20. Из бюретки в коническую колбу прилили 5,0 мл раствора серной кислоты с концентрацией С(1/2 H2SO4)=0,2 M. В этом объеме было
1) 1 ммольH2SO4 2) 0,5 ммольH2SO4 3) 1 ммольэкв. H2SO4 4) 2 ммольэкв.
21. 5 ммольэквсерной кислоты составляет
1) 5,0∙10-6моль экв. 2) 5,0∙10-3моль экв 3) 5,0∙10-9 моль экв 4) 50,0∙10-9 моль экв
22. Водный раствор состоит из 0,02 моль фосфорной кислоты и 200 г воды. Моляльная концентрация раствора
1) 0,1 моль/кг H2O 2) 0.2 моль/ кг H2O 3) 0.4моль/ кг H2O 4) 0.02моль/ кг H2O
23.Водный раствор глюкозы получен растворением 18 г глюкозы в 1798,2 г воды. Мольная доля глюкозы в растворе равна
1) 0,001 2)0,002 3) 0,0034) 0,004
24. В водном растворе объемом 200 мл растворено 1,42 г сульфата натрия. Титр раствора сульфата натрия равен
1) 0,0089 2) 0,0071 3) 0,0054 4) 0,001
25. Выберите номер правильного ответа. В мерной колбе объемом 200 мл растворили 5,299 г карбоната натрия.С(1/2 Na2CO3) равна
1) 0,05 2) 0,03 3) 0,04 4) 0,5
26. Выберите номер правильного ответа. Концентрация щавелевой кислоты С(1/2 H2C2O4)=0,05 M. В 10 мл такого раствора содержится
1) 5∙10-4 моль-экв. 2)0,5 10-4 моль-экв. 3) 1,0∙10-4 моль-экв 4) 50∙10-3 моль экв.
27. Выберите номер правильного ответа. Концентрация перманганата калия С(1/5 KMnO4)=0.1 M. В 20 мл такого раствора содержится
1) 2∙10-4 моль-экв. 2)2,0 10-3 моль-экв. 3) 10,0∙10-4 моль-экв 4) 50∙10-3 моль экв.
28. Выберите номер правильного ответа. n (1/5 KMnO4)=0,01 моль. Молярная масса вещества 158 г/моль. Масса перманганата калия равна в г
1) 1,58 2)15,8 3)0,0316 4)0,316
29. Выберите номер правильного ответа. 10 мл раствора С(1/5 КMnO4)=0,1 М перенесли в мерную колбу 200 мл и довели до метки водой. Молярная концентрация эквивалента перманганата калия в полученном растворе равна
1)0,05М 2) 0,005 М 3)0,01 М 4) 0,001 M
30. Выберите номер правильного ответа. Масса перманганата калия, необходимая для приготовления 200 мл раствора с концентрацией С(1/5KMnO4)=0,1Mравна
1) 3,16 г 2) 6,32 г 3)0,632 г 4) 0,316 г