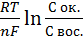ЛЕКЦИЯ № 6, 7
Тема: Электрохимия.
П Л А Н
1. Роль электрохимических явлений в жизнедеятельности человека.
2. Электропроводность растворов. Кондуктометрия.
3. Механизм возникновения электродного потенциала. Э.Д.С. гальванического элемента. Э.Д.С. полости рта при металлопротезировании. Уравнение Нернста.
4. Диффузный и мембранный потенциалы, их расчеты.
5. Понятие о редокс-системах. Уравнение Нернста-Петерса.
Электропроводность – способность веществ проводить электрический ток. Электропроводность L – обозначает величину, обратную сопротивлению проводника тока/
L =  oм-1
oм-1
Если сопротивление проводника прямо пропорционально длине l и обратно пропорционально площади поперечного сечения S
R = r 
r - удельное сопротивление
 - удельная электропроводность, обозначают c
- удельная электропроводность, обозначают c
L = c 
Удельная электропроводность – это есть электропроводность раствора, заключенного между электродами площадью 1 см2 при l = 1 см. Для сравнения проводимости растворов разных электролитов введено понятие эквивалентной электропроводности, т. е. электропроводности раствора, содержащего 1 г – экв электролита, помещенного между электродами на расстоянии 1 см - l.
l = c • n - эквивалентная электропроводность
l - эквивалентная электропроводность равна удельной электропроводности, умноженной на n раствора, содержащий 1 г – экв электролита.
Закон Кольрауша
Предельная молярная электропроводность (l¥) раствора электролита равна сумме молярных подвижностей анионов lА и катионов lК, входящих в состав этого электролита.
l¥ = lА + lК
Кольрауш установил, что при бесконечном разведении катионы и анионы проводят электричество независимо друг от друга, т. к. в этих условиях полностью отсутствует взаимодействие между ионами
l¥ = lА + lК
lА и lК - подвижности катиона и аниона
ln = K • l
при l = 1 ln = l¥
ln - эквивалентная электропроводность при данном разбавлении
тогда
К = l¥
l¥ - эквивалентная электропроводность при бесконечном разбавлении
ln = l¥ • l
l = 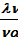
Кондуктометрия – метод измерения электропроводности растворов. Ее используют для определения степени диссоциации, константы диссоциации, определения концентрации электролитов в растворах, растворимости, основности кислот.
Электропроводность различных тканей неодинакова. Наибольшей электропроводностью обладают кровь, лимфа, спинномозговая жидкость. Очень низка она в костных тканях.
Явление электропроводности в тканях человеческого организма имеет большое физиологическое значение и используется в физиотерапии.
1/R oм-1
V мл
Потенциалы, возникающие на металлах, погруженных в растворы собственных солей, называют электродными потенциалами.
Zn + CuSO4 ® ZnSO4 + Cu
Zn + Cu2+ ® Zn2+ + Cu
Zno - 2ē ® Zn2+
Cu2+ + 2ē ® Cuo
Работа окисления Zn, равная убыли изобарно-изотермического потенциала, может быть рассчитана как произведение переносимого электричества на величину э.д.с.
A = - DGo = nEF, где
n – заряд катиона, E – э.д.с., F – число Фарадея
По уравнению изотермы:
- DGo = RTlnK - RTln
Приравниваем два уравнения:
nEF = RTlnK - RTln 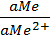
откуда:
E = 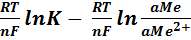
Eo – стандартная э.д.с. элемента
E = 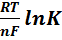 = Eo
= Eo
E = Eo + 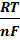
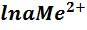 - уравнение Нернста
- уравнение Нернста
Диффузный потенциал возникает на границе раздела растворов разных концентраций. Растворенное вещество диффундирует в раствор с меньшей концентрацией. Если ионы электролита обладают разной скоростью диффузии, то более подвижные ионы оказываются впереди менее подвижных.
e = 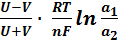
Диффузный потенциал возникает в биологических объектах при повреждении поверхностного слоя (или оболочки клеток). Нарушается избирательность их проницаемости, и электролиты начинают диффундировать в клетку или из нее в зависимости от разности концентраций. Возникает потенциал повреждения или диффузный потенциал. Поврежденная ткань (-), неповрежденная (+).
Eдиф. = 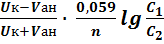
Мембранный потенциал. Возникновение мембранного потенциала связано с особенностями химической структуры и строением мембран, а также с возможным несоответствием размеров ионов и пор в мембране. Величина мембранного потенциала зависит от разности концентраций электролита по обе стороны мембраны.
e = eo + 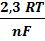 lg
lg 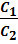
Dj = j2 -j1 Dj = 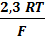 lg
lg 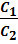
потенциал Доннана
Для клеточных мембран
Уравнение Гольдмана:
Dj =  ln
ln 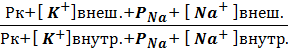
Рк +, РNa + - коэффициенты проницаемости ионов Na+, K+
Окислительно-восстановительный потенциал
О.В.С. (редокс – системой) называется раствор, содержащий окислительную и восстановительную формы одного вещества или нескольких веществ.
Fe3+ |Fe2+ Pb2+ | Pb3+
О.В.П. играют большую роль в физиологии человека и животных.
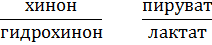
Уравнение Петерса:
E = Eo +