Известно, что регулируемые гены бактерий и бактериофагов могут выключаться или частично подавляться практически на любом этапе экспрессии. Поэтому термин «негативный контроль» используется в научной литературе для описания различных типов регуляции, таких как: расщепление транскрипционной единицы (оперона) в результате рекомбинации, ингибирование транскрипции гена за счет удаления или инактивации компонентов транскрипционного комплекса (например, за счет фосфорилирования субъединиц РНКП), ингибирование инициации транскрипции ДНК-связывающими регуляторными белками (при связывании репрессоров с операторами); ингибирование инициации транскрипции низкомолекулярными соединениями (например, за счет подавления гуанозинтетрафосфатами синтеза цепи мРНК в специфическом промоторе); остановка транскрипции на этапе элонгации до считывания РНКП структурных генов (аттеньюация), ингибирование транскрипции в результате нуклеолитического расщепления мРНК (ретроингибирование), подавление инициации трансляции трансляционным репрессором, специфический протеолиз белка-активатора транскрипции и т.д. (37). При этом негативный контроль, осуществляемый с помощью белков-репрессоров на уровне инициации транскрипции, является одним из самых распространенных механизмов регуляции экспрессии генов.
Часто функция репрессора описывается попросту как ингибирование связывания РНКП с промотором. Такое представление основано на ранних сведениях о том, что репрессоры: (I) специальные белки, предназначенные только для подавления транскрипции, (II) работают, взаимодействуя со специфическими участками ДНК (операторами), перекрывающими участки связывания РНКП (промоторы), и (III) обладают более высоким сродством к операторам, чем РНКП к промоторам. Однако новая информация о том, что репрессоры действуют иногда как активаторы, а активаторы как репрессоры, и что нередко операторы разделены на части и не перекрывают функциональные сайты промоторов (38), потребовала исследовать действие репрессоров не только на уровне связывания РНКП с ДНК, но и на других стадиях инициации транскрипции. Подавляющее большинство работ в этой области было посвящено изучению «канонических» промоторов E. coli и Salmonella typhimurium, зависимых от РНКП, содержащей s70 (s, сигма-фактор, варьирующая субъединица РНКП, отвечающая за специфичность узнавания определенных промоторов). Тем не менее, основные закономерности репрессии, описанные для канонических промоторов энтеробактерий, соблюдаются для всех негативно регулируемых промоторов бактериальных генов.
Бифункциональные регуляторные белки. Долгие годы существовал стереотип строгого функционального разделения регуляторных белков на репрессоры и активаторы транскрипции. Согласно современным данным многие, если не все, регуляторные белки являются бифункциональными: в зависимости от обстоятельств они могут активировать или репрессировать транскрипцию. Многие из них позитивно или негативно регулируют свои собственные гены (авторегуляция) (39). Показательно также, что и репрессоры, и активаторы могут относиться к семейству родственных белков. Более того, и те, и другие способны воздействовать на одни и те же стадии инициации транскрипции. В совокупности эти данные позволяют предполагать, что две противоположные функции регуляторных генов имеют общее эволюционное происхождение.
РНКП и функционально важные элементы промотора. Промотор – это сегмент ДНК, с которого РНКП инициирует транскрипцию. Для промотор-зависимой инициации транскрипции необходимы апофермент РНКП (E) и субъединица специфичности (s-фактор). Апофермент E является стабильным, связанным не ковалентно комплексом четырех полипептидных цепей: двух a, одной b и одной b ', которые кодируются генами rpoA, rpoB, и rpoC, соответственно. В нормальных условиях роста транскрипция большинства генов E. coli инициируется холоферментом РНКП Es70, в котором субъединица s70 является продуктом гена rpoD (40, 41).
Структурно-функциональные элементы промотора представляют те участки ДНК, где замены нуклеотидов влияют на нормальный уровень инициации транскрипции в специфической точке старта (обозначается как +1). К настоящему времени проведен статистический анализ около 300 промоторов, узнаваемых Es70 в клетках E. coli и ДНК бактериофагов (41). Этот анализ показал ключевое значение трех элементов центральной (коровой) части промоторов: двух консервативных последовательностей по 6 пн с центрами на расстоянии примерно 10 и 33 пн выше точки старта, названы (–10)- и (–35)-гексамерами, а также разделяющего их участка, спейсера, чаще всего состоящего из 17 пн, но варьирующего от 15 до 21 пн у различных промоторов. Рис. 4 схематично, на примере только нетранскрибируемой цепи ДНК, соответствующей РНК-транскрипту, изображает обобщенную, консенсусную первичную структуру «корового» промотора для Es70 (41). При сравнении с такой последовательностью последовательностей нуклеотидов большинства реальных промоторов выявляется не менее 7 совпадений в 12 нуклеотидах гексамеров –35 (TTGACA) и –10 (TATAAT). Более того, у многих промоторов в точке старта (+1) встречается нуклеотид А, тогда как фланкирующие основания – это чаще всего С (–1) и Т (+2).
Консервативность нуклеотидов корового промотора свидетельствует об их функциональной значимости. Как правило, промоторы E. coli, в которых Es70 инициирует транскрипцию на достаточно высоком уровне, не имеют в целом больше 3 отличий от консенсуса корового промотора: по составу элементов (–10) и (–35) и длине (17 пн) спейсера (41). Направленные замены нуклеотидов, снижающие степень гомологии промотора с «консенсусом», обычно обусловливают падение эффективности инициации транскрипции. Кроме того, дополнительные элементы, расположенные выше и ниже коровой последовательности, могут принимать участие в функционировании промоторов, подавляющую часть которых представляют сильные промоторы (37). К числу дополнительных элементов относятся так называемые UP (upstream), USR (upstream regulatory) и DSR (downstream regulatory) элементы (рис. 4; табл. 1).
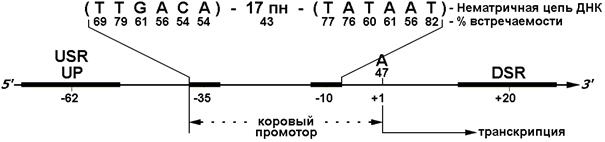
Рис. 4. Структура консенсуса специфичных для Es70 промоторов у E. coli (41). Средние статистические (–10)- и (–35)-гексамеры, а также длина спейсерного участка (17 пн) выведены на основании сравнения между собой около 300 индивидуальных промоторов; указан процент встречаемости наиболее консервативных нуклеотидов. Элементы USR, UP и DSR являются дополнительными (см. текст), и не все промоторы их содержат.
Активность промотора и мишени репрессии. Инициация транскрипции – это процесс, проходящий в несколько стадий (37, 41):
Стадия 1. Связывание РНКП с промотором, или формирование «закрытого» комплекса РНКП-промотор (РПз);
Стадия 2. Изомеризация РПз, или формирование «открытого» комплекса РНКП-промотор (РПо), в котором происходит релаксация двойной спирали ДНК;
Стадия 3. Конверсия РПо в комплекс инициации РНКП-промотор (РПи) за счет образования первой фосфодиэфирной связи в РНК (2 рибонуклеозида);
Стадия 4. Синтез «непродуктивных» олигомеров РНК на «холостом» или «запинающемся» ходу РНКП;
Стадия 5. Конверсия РПи, «холостого» или «запинающегося» комплекса в комплекс элонгации (РПэ) – «покидание», или освобождение промотора РНКП.
Любая из стадий инициации транскрипции, представленных здесь в схематично-упрощенном виде, может служить потенциальной мишенью действия белков-репрессоров (и активаторов).
Табл. 1. Типичные функции структурных элементов промотора (37)
| Элемент | Функция |
| Гексамер (–35) | Связывание s-фактора |
| Гексамер (–10) | Связывание s-фактора и изомеризация РПзàРПо |
| Спейсер (17 пн) | Связывание РНКП и изомеризация РПзàРПо |
| Up-элемент* | Связывание a-субъединицы и формирование РПз |
| USR-элемент* | Влияет на «холостой» ход РНКП и/или РПэ |
| DSR-элемент | Влияет на «холостой» ход РНКП и/или РПэ |
*элементы Up и USR, детерминирующие регуляторное изгибание ДНК,
совпадают топологически, но им присущи разные функции (см. текст)
Природа промоторов. Промотор несет в себе информацию обо всех стадиях инициации транскрипции. Известные функции структурных элементов привязаны к тому или иному этапу инициации транскрипции довольно приблизительно (37; табл. 1), поскольку функциональное проявление одного и того же элемента может видоизменяться в составе индивидуальных промоторов. Существуют свидетельства различного влияния элементов друг на друга, причем вклад каждого в общую активность промотора зависит от ряда обстоятельств: первичной структуры, взаимного расположения и т. д. (42, 43). Следовательно, каждый промотор должен был эволюционировать таким образом, чтобы установился специфический баланс структурных элементов, адекватный биологической потребности данного промотора. При неизменной РНКП возможны два пути модуляции активности промотора: изменение последовательности нуклеотидов в составляющих промотор элементах и использование регуляторных белков. Обладая этими двумя инструментами для оптимизации, понижения или повышения эффективности инициации транскрипции, природа сконструировала три класса промоторов: конститутивные, слабые и сильные (37).
У конститутивных промоторов последовательность нуклеотидов структурных элементов такова, что инициация транскрипции происходит на фиксированном уровне, предпосланном потребностями клетки. Такие промоторы нерегулируемы.
У слабых промоторов последовательность нуклеотидов структурных элементов детерминирует низкую эффективность инициации транскрипции на одной или нескольких стадиях. Такие дефектные от природы промоторы переходят в разряд сильных, если их работу стимулируют белки-активаторы. Активаторы ускоряют лимитирующую(ие) стадию(и) инициации транскрипции в ответ на потребность клетки. Это – позитивный контроль экспрессии генов.
У сильных промоторов уровень инициации транскрипции высокий благодаря определенному балансу структурных компонентов (или действию белков-активаторов). Высокая активность таких промоторов может подавляться, т. е. они становятся низкоэффективными или даже неактивными, за счет ингибирования репрессорами любой из стадий инициации транскрипции. По сути, это – негативный контроль экспрессии генов.
Молекулярные механизмы репрессии, за исключением тех, которые связаны с контролем самих белков-регуляторов до взаимодействия их с ДНК, могут быть разделены на шесть основных типов.
1. Пространственное препятствие. Как уже упоминалось, простейшим способом подавления инициации транскрипции является блокирование образования комплекса РПз благодаря связыванию репрессора с оператором, перекрывающим промотор. Данный механизм, считающийся по широко распространенному мнению преимущественным механизмом репрессии, в действительности был экспериментально подтвержден всего в нескольких случаях, в частности, при взаимодействии репрессора LexA с промотором гена uvrA, репрессора LacI – с мутантным lac -промотором (P UV5) и репрессора CI – с промоторами ранних генов фага l (44, 45, 46). Молекулярные аспекты модели «пространственного препятствия» легко объяснимы сами по себе. Кроме перекрывания промотора оператором, эта модель требует, чтобы взаимодействие репрессора с оператором характеризовалось большей аффинностью, чем взаимодействие РНКП с промотором.
2. Белок-белковое взаимодействие. Для стадий инициации транскрипции, следующих за образованием комплекса РПз, были постулированы более сложные молекулярные механизмы репрессии. Один из них предполагает одновременное связывание репрессора и РНКП с ДНК и ингибирование активности РНКП посредством прямого контакта между репрессором и РНКП. Биохимические последствия такого действия репрессора должны быть противоположны результатам позитивного контроля, осуществляемого белками-активаторами на стадиях после связывания с ДНК (26, 47). За счет прямого белок-белкового контакта с РНКП репрессор может аллостерически ингибировать любое конформационное изменение коплекса РПз на последующих стадиях инициации, например, формирование комплекса РПо, РПи или даже РПэ.
3. Воздействие через ДНК. Поскольку структура промотора сама по себе играет активную роль в инициации транскрипции, функция регуляторного белка может проявляться опосредованно через действие на ДНК (37). Действительно, известны отдельные примеры такого молекулярного механизма репрессии, когда, изменяя третичную структуру ДНК, репрессор затрудняет работу РНКП. При этом, структура промотора может изменяться вследствие связывания репрессора не только в непосредственной близости к промотору, но и в удаленном сайте(ах).
4. Противодействие «кэйджингу» РНКП. В сильных промоторах РНКП взаимодействует не только с коровыми элементами, (–35), спейсер, (–10), но и с примыкающими регуляторными UP, либо USR, и DSR сегментами в положениях (–62) и (+20), соответственно (рис. 4). Необходимость образования контактов с РНКП на большом в целом участке нуклеотидной последовательности (до 112 пн) требует, чтобы ДНК обворачивала (кэйджинг) РНКП (48, 49; рис. 5,а). Одним из подтверждений кэйджинг-модели служит то, что изгибание ДНК в UP- (либо USR-) участке в направлении связавшейся РНКП максимально повышает активность промотора (50). Если изгибание ДНК не детерминировано самой первичной структурой UP-элемента, то этому может способствовать белок-активатор, который связывается с таким UP-элементом (обозначаемым теперь иначе – USR) и оказывается в роли «клина», осуществляющего локальный контакт между РНКП и обворачивающей ее ДНК (51; рис. 5,б). Действие белка-репрессора, напротив, может создавать пространственные помехи при образовании продуктивного комплекса инициации транскрипциии (52). Например, некоторые репрессоры, связываясь с операторами, изгибают ДНК в противоположную сторону от формирующегося комплекса РНКП-промотор (рис. 5,в). Поскольку определенные специфические контакты между РНКП и ДНК ответственны за эффективность реализации определенных стадий инициации транскрипции, положение оператора относительно элементов промотора существенно влияет на характер и уровень репрессии (37).

Рис. 5. Схемы пространственных взаимодействий РНКП, ДНК и регуляторных белков в сильных промоторах: (а) Обворачивание ДНК вокруг РНКП (кэйджинг) для повышения эффективности инициации транскрипции; (б) Участие белка-активатора в кэйджинге – контакт с ДНК, изгибание ДНК и образование контакта с РНКП; (в) Изгибание ДНК под действием белка-репрессора в противоположную сторону от комплекса РНКП-промотор; (г) Образование «репрессорной» петли ДНК в области промотора при связывании белка-репрессора с составным оператором (см. в тексте ниже).
5. Составные операторы и образование петли ДНК. Нередко операторы представлены несколькими раздельными элементами (38, 39). Связывание репрессора с различными частями составного оператора имеет различные биохимические последствия. В классическом примере негативного контроля экспрессии ранних генов фага l сила взаимодействия репрессора CI с тремя тандемными операторными участками дифференцирована, и это является предпосылкой кооперативного связывания репрессора, обеспечивающего, в частности, тонкую регуляцию одновременно двух противоположно направленных промоторов, P M и P R (53). Однако данный случай является иллюстрацией вышеописанного механизма репрессии по принципу пространственного препятствия. Дальнейшее изучение систем, в которых два или три операторных участка контролируют один промотор (или два однонаправленных смежных промотора), привело к открытию еще одного механизма репрессии. Этот механизм основан на формировании петли ДНК в результате прямого контакта между двумя репрессорами, связавшимися с ДНК в двух удаленных друг от друга операторных участках. Например, при взаимодействии двух репрессоров, связанных с операторами, окружающими промотор, последний окажется внутри образуемой петли ДНК (рис. 5,г). Такие петли ДНК, возникающие в процессе физических контактов между ДНК-связывающими белками, служат удобной моделью для изучения активной роли ДНК в регуляции экспрессии генов (38, 54). Структура ДНК в петле способна измениться таким образом, что промотор будет невосприимчив к той или иной фазе функционирования РНКП. Особенности такой регуляции промоторной активности зависят от стабильности петли ДНК и характера происходящих в ней структурных изменений. Поскольку образованию петли всегда противостоит присущая двойной спирали ДНК упругость, или устойчивость к сближению двух соседних участков, энергия, высвобождаемая в результате взаимодействий репрессор-оператор и репрессор-репрессор, должна превышать энергетические затраты на изгиб и дополнительное закручивание дуплекса ДНК в петле. Успешному выполнению этого условия in vivo способствует наличие суперспиральных участков и локальных искривлений ДНК, а также природная эластичность белков (54, 55).
6. Антиактивация. Перечень механизмов негативного контроля экспрессии генов на уровне инициации транскрипции дополняет репрессия связывания или функционирования белка-активатора в слабом промоторе. Хотя примеры антиактиваторной роли репрессоров известны и у бактерий, этот тип регуляции генного действия больше характерен для эукариот (37).