Практическое занятие №2
«Физико-химические свойства белков. Аминокислотный состав белков.
Электрофоретические и хроматографические методы»
Задание 1. Разделение аминокислот хроматографией на бумаге
Для быстрого разделения аминокислот можно воспользоваться методом круговой хроматографии на бумаге (используют специальную фильтровальную бумагу).
Ход работы: Раствор смеси трех аминокислот (3 мкл) наносят в центр фильтраи высушивают на воздухе. Фильтр помещают между половинками чашки Петри, нижняя из которых наполовину заполнена растворителем: н-бутанол + ледяная уксусная кислота + вода (12:3:5). Через 1,5–2 часа, когда диаметр растворителя составит 4–6 см, фильтр высушивают для удаления растворителя и разрезают на две части.
А) Первую половину фильтра (хромотограммы) быстро проводят через раствор нингидрина в ванночке и помещают в сушильный шкаф (при температуре 80–100°С) на 5–10 мин. На диске появляются три окрашенных кольца, соответствующие гистидину, аланину и тирозину.
Химические реакции: Нингидрин реагирует с аминокислотами следующим образом:
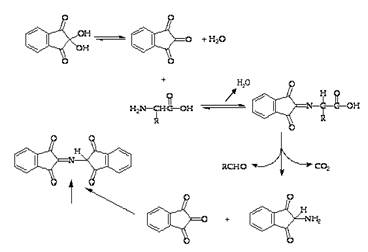
|
Б) Вторую половину фильтра используют для выявления гистидина и тирозина с помощью реакции Паули. Для этого ½ фильтра (хромотограмму) проводят через раствор диазобензолсульфоновой кислоты, высушивают, проводят через 10%-ный раствор карбоната натрия и высушивают. Гистидин окрашивается в красный, а тирозин в оранжевый цвет. Реакция Паули протекает следующим образом:

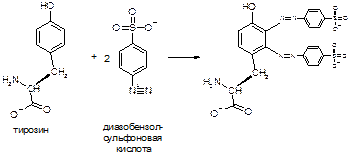
Задание 2. Гель-хроматография на колонке сефадекса G-75
ДЕМОНСТРАЦИЯ
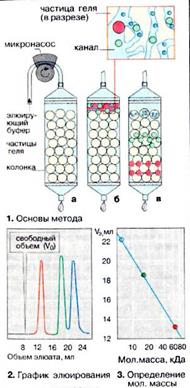
| Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков (1б) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля (1в). На выходе колонки элюат собирают в виде отдельных фракций (2). Объем выхода того или иного белка зависит в основном от его молекулярной массы (3). |
 
| Сефадекс представляет собой полимеризованный декстран, формируемый в виде бусин. Сефадекс готовиться поперечным сшиванием декстрановых цепей эпихлоргидрином. Благодаря высокому содержанию гидроксильных групп в полисахаридных цепях Сефадекс сильно гидрофилен и потому набухает в воде и растворах электролитов. Степень набухания, как и размер пор в гранулах Сефадекса зависит от степени сшитости декстрановых цепей: чем выше соотношение декстран: эпихлоргидрин, тем больше число поперечных сшивок, тем меньше размер пор и степень набухания. Детекция хроматографических зон, соответствующих отдельным белкам, может осуществляется измерением оптической плотности отдельных фракции при 280 нм или 230 нм. Результаты измерения представляются в виде зависимости между оптической плотностью фракций и объемом элюата, вышедшего с колонки, или временем хроматографического разделения. При использовании проточного адаптора, перистальтического насоса, UV- монитора, самописца (или компьютера) и коллектора фракций измерение оптической плотности, вычерчивание графика элюции и сбор фракций осуществляются автоматически. При разделении окрашенных компонентов интенсивность окраски фракций оценивают спектрофотометрически в видимой области спектра или визуально. |
ПРАКТИЧЕСКИЕ УКАЗАНИЯ:
Необходимое оборудование и реактивы:
- Колонка с адаптером фирмы Pharmacia XK 1,0 х 40 см на штативе,
заполненная сефадексом G-75;
- Коллектор фракций 2112/2212 Heurac фирмы LKB;
- Пробирки для сбора фракций;
- Элюирующий буфер – 0,9%-ный раствор NaCl.
Ход работы:
1. Нанесение пробы: Для аналитических целей, когда основной задачей является достижение возможно лучшего разделения, стартовая зона должна быть узкой. Образец вносят с помощью перистальтического насоса, скорость внесения составляет ½ от скорости элюции; объем анализируемой пробы 1 мл.
Голубой декстран – 1 мг
Цитохром С – 1,5 мг в 1 мл 0,9%-ном NaCl
К2CrO4 – 2 мг
Сахароза – 200 мг (для уплотнения анализируемой пробы)
2. Параметры элюции: Движение элюирующего буфера осуществляют с помощью перистальтического насоса. В качестве элюента используют – 0,9%-ный раствор NaCl. Скорость протекания элюента через колонку составляет 25 мл/час.
3. Сбор фракций: Фракции собирают с помощью коллектора фракций. Объем фракции зависит от параметров колонки, объемов образца и его состава, а также соотношения высоты стартовой зоны и длины гелевого ложа. При аналитической хроматографии объем собираемых фракций, как правило, составляет 2 мл.
4. Детекция хроматографических зон: Детекция хроматографических зон осуществляется визуально.
5. Анализ и оформление полученных результатов: Рассчитать Ve, Vt, Vo, Vi, Kav
Задание 3. Проведение диализа
ДЕМОНСТВАЦИЯ
Диализ является одним из способов отделения белков от низкомолекулярных веществ. Крупные молекулы, такие как молекулы белков, остаются внутри диализного мешочка, сделанного из материала, содержащего ультрамикроскопические поры (строго калиброванного размера). Если такой мешочек с раствором белка поместить в буферный или водный раствор, то содержащиеся там небольшие молекулы, например, ионы солей, пептиды, другие низкомолекулярные вещества пройдут через поры, а высокомолекулярные молекулы белков, молекулярная масса которых превышает 15 кДа, останутся внутри мешочка. Для иллюстрации принципа диализа поместите смесь высокомолекулярного вещества голубого декстрана (молекулярная масса 2000000 Да) и низкомолекулярного бихромата калия в диализный мешочек. Оба эти вещества окрашены: первое – в синий цвет, а второе – в оранжево-желтый цвет. За ходом диализа удобно следить по изменению цвета растворов внутри мешочка и в сосуде для диализа: низкомолекулярная соль (бихромат калия) будет выходить в раствор, окрашивая его в желтый цвет.
 |
Задание 4. Электрофорез белков в полиакриламидном геле в присутствии ДДС-Na
Принцип метода: Диск-электрофорез представляет собой метод разделения, в котором используется неоднородная («прерывистая») разделяющая система с полиакриламидным гелем в качестве носителя. При диск-электрофорезе применяют пары буферов разного состава и с разными значениями рН, а носитель состоит из отдельных слоев геля, отличающихся друг от друга по размерам пор. Благодаря этому разделяемые вещества концентрируются сначала в очень узкой стартовой зоне в полосе крупнопористого геля, что имеет решающее значение для четкого разделения в мелкопористом геле по величине, форме и заряду молекул. Таким образом, высокая разрешающая способность диск-электрофореза базируется на двух физических явлениях: эффекте концентрирования и эффекте молекулярного сита. Диск-электрофорез в ПААГ с ДДС-Na позволяет фракционировать белки в зависимости от значений только одного параметра – их молекулярной массы. Сравнивая ЭФ-подвижность полипептидов образца с подвижностью белков-маркеров с известной молекулярной массой можно определить молекулярную массу анализируемых полипептидов. С этой целью строят график зависимости десятичного логарифма молекулярной массы от относительной электрофоретической подвижности Rf для белков маркеров. Определив теперь Rf интересующего нас полипептида, на графике можно найти для него величину lgM и подсчитать молекулярную массу.
ПРАКТИЧЕСКИЕ УКАЗАНИЯ:
С помощью диск-электрофореза в ПААГ в присутствии ДДС-Na по методу Лэммли (Laemmli, 1970) получить электрофоретический спектр анализируемых проб, содержащих лактоферрин, охарактеризовать их в сравнении с ЭФ-спектром белков-маркеров с известными молекулярными весами.
Необходимое оборудование:
1) Камера Mini-protean®3 cell (фирма Bio-Rad)
2) Источник питания PowerPac Basic или PowerPac HC, фирмы «Bio-Rad»
3) Шейкер – UltraRocker Rocking Platform фирмы Bio-Rad
4) Система для визуализации и регистрации результатов электрофореза – система гель-документирования высокого разрешения ChemiDoc XRS фирмы «Bio-Rad»
5) Шприц «Гамильтон» для нанесения проб или механический дозатор (0,2 – 10 мкл) со сменными пластмассовыми наконечниками для нанесения проб на ПААГ.
Необходимые реактивы:
! Из растворов, описанных в п. 1, 2 и 5, заранее сформированы блоки с ПААГ.
1) Раствор для приготовления разделяющего геля: 12%-ный акриламид – 0,4%-ный N,N′-метиленбисакриламид на буфере 0,1%-ный ДДС-Na – 0,375 М трис-HCl, рН 8,8. Непосредственно перед формированием геля к этому раствору добавляют ТЕМЕД и персульфат аммония (ПСА) до конечной концентрации 0,025%.
2) Раствор для приготовления концентрирующего геля: 3%-ный акриламид – 0,16%-ный N,N′-метиленбисакриламид на буфере 0,1%-ный ДДС-Na – 0,125 М трис-HCl, рН 6,8. Непосредственно перед формированием геля к этому раствору добавляют ТЕМЕД и ПСА до конечной концентрации 0,05%.
3) Электродный буфер: 0,1%-ный ДДС-Na – 0,192 М глицин – 0,025 М трис, рН 8,3.
4) Раствор для приготовления пробы: Перед электрофорезом к каждой пробе добавляют равный объем раствора для проб: 4%-ный ДДС-Na – 10%-ный 2-β-меркаптоэтанол – 0,25 М трис-HCl, рН 6,8. Смесь инкубируют на кипящей водяной бане в течение 1,5-2 мин, охлаждают и уплотняют кристаллической сахарозой до конечной концентрации 9%-ов. Кроме того, к пробе добавляют лидирующей краситель бромфеноловый синий до конечной концентрации 0,01%.
5) Растворы 10%-ного ТЕМЕД и 10%-ного ПСА (!свежеприготовленный)
6) Раствор для фиксации полиакриламидного геля – 50%-ный этанол
7) Раствор для окрашивания белков в ПААГ – 0,125%-ный Кумасси G-250 на 40%-ном этаноле
8) Раствор для отмывки и хранения геля – 5%-ная уксусная кислота
Ход работы:
1. Сборка электрофоретического модуля:

| 
|
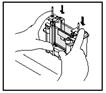
| а) Извлеките сэндвич кассеты с гелем из рамки для заливки геля, предварительно раскрыв зажимы. | б) Поместите сэндвичи кассет с гелем с обеих сторон на U-образный электродный блок (вместо одной из кассет можно использовать блокирующую пластиковую пластину). Короткое стекло при этом должно смотреть внутрь блока (во внутреннюю камеру). |
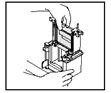
| 
|
| с) Скользящим движением поместите U-образный электродный блок с двумя кассетами с гелем в фиксирующий каркас. | д) Прижмите электродный блок до упора и защелкните два зажима фиксирующего каркаса. |

| |
| е) Поместите собранный внутренний блок в камеру. |
Залейте во внутреннюю (верхнюю) камеру ~ 125 мл буфера для электрофореза, так, чтобы граница буфера была выше верхнего края короткого стекла. Затем залейте ~ 200 мл буфера для электрофореза в нижнюю камеру.
2. Нанесение проб:
Заранее подготовленные анализируемые пробы, смешанные с раствором для проб, вносят под электродный буфер в карманы с использованием механического дозатора с соответствующими сменными наконечниками. Наконечник пипетки вводят в лунку до уровня, который примерно на 1-2 мм выше дна ячейки. Пробу следует вносить медленно и аккуратно, наслаивая ее на дно кармана.