Вопросы для коллоквиума, собеседования с глоссарием по разделам 1-3
(глоссарий от лат. glossarium — «собрание глосс», теза́урус от греч. θησαυρός — «сокровищница»,
гиперссылки для выполнения индивидуальных проектов по темам № 513-594)
по разделу (теме):
1 Химия: основные понятия. Валентность, степень окисления, эмпирические и структурные формулы соединений. Классы, названия соединений и их основные свойства
1. Атом, молекула, ион (катион, анион). Валентность (ковалентность). Степень окисления элемента в веществе.
2. Химический элемент, изотопы.
3. Эмпирические формулы и структурные формулы веществ.
4. Простые вещества. Cложные неорганические вещества (соединения). Класс органических соединений.
5. Основны́е оксиды и их свойства. Кислотные оксиды, их свойства.
6. Амфотерные оксиды и их свойства.
7. Кисло́ты и их свойства.
8. Основания (осно́вные гидрокси́ды) и их свойства.
9. Со́ли и их свойства.
10.Комплексное соединение. Лиганд, комплексообразователь, координационное число.
1. 1. Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательных электронов; наименьшая химически неделимая частица, входящая в состав простых и сложных веществ.
1. 2. Молекула – наименьшая частица данного вещества, обладающая его химическими свойствами; наименьшая электронейтральная замкнутая совокупность атомов, образующих определенную структуру с помощью химических связей.
1.3. Валентность (ковалентность) В – число электронных пар, связывающих данный атом с другими атомами в конкретном соединении. Имеет смысл только для соединений, в которых все химические связи являются двухцентровыми, т.е. каждая связь осуществляется парой электронов, находящейся между двумя атомами в молекуле. В большинстве соединений определяют не валентность, универсальную С.О.
1.4. Степень окисления С.О.– заряд, который приобрел бы атом, если бы все химические связи были чисто ионными, т.е. если бы все электронные пары были сдвинуты в сторону более электроотри-цательного элемента. Для молекул, состоящих из одинаковых атомов, равна нулю. Степень окисления в ряде случаев не совпадает с валентностью. Например, в органических соединениях углерод всегда четырёхвалентен, а степень окисления атома углерода в соединениях метана CH4, метилового спиртаCH3OH, формальдегида HCOH, муравьиной кислоты HCOOH и диоксида углерода CO2, соответственно, равна −4, −2, 0, +2 и +4. Может быть дробная.
Степень окисления конкретного элемента в веществе
• 0 в простых веществах: H20, О30, S80.
• +1 для Н (в гидридах щелочных мет.- I) и щелочных мет.; H+2O, H+2SO4, Na+H-.
• +2 – для щелочноземельных мет. и Zn: Ca+2(OH)2, Zn+2 О.
• +3 – для В, Аl: (Al+3(OH)3.
• -2 – для атомов кислорода (в перекисях -I): H+2O-2;, H+2O2-
Переменная С.О. для др. элементов, рассчитывается исходя из электронейтральности молекулы. С.О. в ряде случаев не совпадает с валентностью. Например, в органических соединениях углерод всегда четырёхвалентен, а степень окисления атома углерода в соединениях метана CH4, метилового спирта CH3OH, формальдегида HCOH, муравьиной кислоты HCOOH и диоксида углерода CO2, соответственно, равна −4, −2, 0, +2 и +4.
1.5. Химический элемент – вид атомов, характеризующийся определенным зарядом ядра, включающий все его изотопы. Например Н – атом водорода, состоит из элементов протия 11Н, дейтерия12Н и трития 13Н. Радиоактивные эдементы подвергаются ядерным реакциям.
1.6. Эмпирические формулы показывают сколько каких атомов содержится в молекуле: Оксид углерода(IV) CO2.
1.7. Структурные формулы дополнительно показывают валентность каждого атома (число электронных пар, т.е. связей черточками или парами точек): О=С=О или О: С: О.
1.8. Простые вещества состоят из одинаковых атомов: H2- водород О2, - кислород, О3- озон, N2 - азот, Cl2 - хлор, S - сера, S8 – газообразная сера C - углерод, C60 - фуллерен.
1.9. Cложные неорганические вещества (соединения) состоят из нескольких различных атомов: 1) оксиды (H2O, CaO, CO2, P2O5 (P4O10) и др.) бывают: не образующие гидроксидов (не кислотообразующие, например СО, NO), кислотные, основные, амфотерные
2) гидроксиды: основания (Na(OH), Ca(OH)2 и др.); кислородосодержащие кислоты (HNO3, H2SO4, H3PO4 и др.); амфотерные гидроксиды (Al(OH)3, Fe(OH)3 и др.); 3) безкислородные кислоты (HCl, HCN и др.); 4) соли (NaCl, KNO3, Fe2(SO4)3, LiBr и др.), кристаллогидраты солей: (CuSO4·5H2O и др.) 5) комплексные соединения: (K3[Fe(CN)6] и др.)
1.10. Класс органических соединений. Химические соединения делят на классы: неорганические и органические. Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).
1.11. Кислотные оксиды (ангидриды) – оксиды, растворяющиеся только в щелочах, с образованием соли и воды. Образуются типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных оксидах обычно проявляют валентность от IV до VII. Оксид углерода(IV) CO2;Оксид серы(IV) SO2; Оксид серы(VI) SO3; Оксид кремния(IV) SiO2; Оксид фосфора(V) P2O5; Оксид хрома(VI) CrO3; Оксид марганца(VII) Mn2O7; Оксид хлора (VII) Cl2O7
1.12. Основны́е оксиды – оксиды, которым соответствуют основания. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr; оксиды металлов главной подгруппы второй группы (щелочноземельные металлы) Be — Ra, оксиды переходных металлов в низших степенях окисления. Металлы в основных оксидах обычно проявляют степень окисления +1 и +2. Основные оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с оксида кальция) при взаимодействии с водой (реакция гидратации) образуют соответствующие им гидроксиды (основания). Например, при растворении оксида кальция (негашёной извести) в воде образуется гидроксид кальция – сильное основание: СаO + H2O → Са(OH)2. Оксид лития Li2O; Оксид натрия Na2O; Оксид калия K2O; Оксид серебра Ag2O; Оксид магния MgO; Оксид кальция CaO; Оксид стронция SrO; Оксид бария BaO; Оксид ртути HgO; Оксид марганца MnO; Оксид хрома CrO; Оксид никеля NiO; Оксид франция Fr2O; Оксид цезия Cs2O; Оксид рубидия Rb2O; Оксид меди CuO, Оксид железа(II) FeO.
1.13. Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют валентность II, III, IV. Оксид цинка ZnO, Оксид хрома(III) Cr2O3, Оксид алюминия Al2O3, Оксид олова(II) SnO, Оксид олова(IV) SnO2, Оксид свинца(II) PbO, Оксид свинца(IV) PbO2, Оксид титана(IV) TiO2, Оксид марганца(IV) MnO2, Оксид железа(III) Fe2O3, Оксид бериллия BeO.
ZnO + H2SO4 → ZnSO4 + H2O; ZnO + 2NaOH → Na2ZnO2 + H2O; Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
1.14. Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, в частности лакмуса на красный. H2CO3 – неустойчивая, H2S – летучая кислота.
| № | Формула кислоты | Название кислоты | Название солеи | № | Формула кислоты | Название кислоты | Название солеи |
| Н2ZnО2 | Цинковая | Цинкаты | Н3РО4 | (Орто-)фосфорная | (Орто-) фосфаты | ||
| Н3АlО3 | Алюминиевая | Алюминаты | Н3АsО4 | Мышьяковая | Арсенаты | ||
| НАlО2 | Метаалюминиевая | Метаалюминаты | H2SO3 | Сернистая | Сульфиты | ||
| Н3ВО3 | (Орто)- борная | (Орто-бораты | H2SO4 | Серная | Сульфаты | ||
| Н2В4О7 | Тетраборная | Тетрабораты | H2S | Сероводород | Сульфиды | ||
| Н2СО3 | Угольная | Карбонаты | H2СrO4 | Хромовая | Хроматы | ||
| Н2С2О4 | Щавелевая | Оксалаты | HMnO4 | Марганцовая | Перманганаты | ||
| СН3СООН | Уксусная | Ацетаты | H2МnO4 | Марганцовистая | Манганаты | ||
| HCN | Циановодород | Цианиды | НСl | Хлороводород | Хлориды | ||
| HCNS | Родановодород | Роданиды | НСlO | Хлорноватистая | Гипохлориты |
1.15. Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
1.16. Со́ли — класс химических соединений, состоящих из катионов и анионов. В роли катионов в солях могут выступать катионы металлов, ониевые катионы (катионов аммония 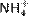 , фосфония
, фосфония 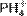 , гидроксония
, гидроксония 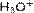 и их органические производные), комплексные катионы и т.д., в качестве анионов — анионы кислотного остатка различных кислот, включая комплексные анионы и т.п.
и их органические производные), комплексные катионы и т.д., в качестве анионов — анионы кислотного остатка различных кислот, включая комплексные анионы и т.п.
1.17. Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. Комплексная частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. [(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II), [Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II), K2[BeF4] — тетрафторобериллат(II) калия,Li[AlH4] — тетрагидридоалюминат(III) лития, K3[Fe(CN)6] — гексацианоферрат(III) калия, [Ni(CO)4] — тетракарбонилникель, [Pt(NH3)2Cl2] — дихлородиамминплатина(II).
Типы химических реакций
1. Хими́ческая реа́кция. Типы реакций: - окислительно-восстановительные реакции ОВР и не ОВР;реакции присоединения (ассоциации, агрегации), разложения (отщепления), обмена и замещения, перегруппировки; - нейтрализации, необратимые; обратимые;, эндотермические; реакции. комплексообразования; простые, сложные; - гомогенные, гетерогенные.
2. Окислителыные, восстановительные реакции. реакции диспропорционирования, Вещества окислители и восстановители.
3. Реакции нейтрализации. Ионнообменная реакция. В каких случаях идёт ионообменная реакция. Электрохимическая реакция. Электроды. Анод.
4. Основные закономерности электрохимического процесса.
5. ЕДС гальванического элемента.
2.1. Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
2.2. Различают типы реакций: - окислительно-восстановительные реакции ОВР и не ОВР;
- реакции присоединения (ассоциации, агрегации) АВ + С → АВС, разложения (отщепления) АВС → АВ + С, обмена и замещения (число частиц в правой и левой части одинаково) В + С → АС + В, перегруппировки АВС → АСВ;
- нейтрализации, необратимые – реакции, протекающие только в одном направлении до полного израсходования одного из реагирующих веществ; обратимые – процессы, в которых одновременно протекают две взаимно противоположные реакции – прямая и обратная; экзотермические – проходящие с выделением тепла, эндотермические – с поглощением тепла;
- реакции комплексообразования (переноса электронных пар): Fe+3€€€€€€ + 6:СN- ® [ Fe (СN)6]-3,
кислота (по-Льюису) акцептор основание
(по-Льюису)
- простые – реакции протекающие в одну стадию, сложные – реакции протекающие в несколько стадий, каждая из которых является простой. Скорость сложной реакции определяется скоростью наиболее медленной лимитирующей стадии;
- гомогенные – реакции характеризующиеся отсутствием поверхности разделе между реагентами, поэтому их взаимодействие протекает по всему объёму, гетерогенные – реакции, характеризующиеся наличием поверхности раздела, где и протекает взаимодействие и другие типы.
2.3. Окислительно-восстановительные реакции, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции диспропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления. Окислитель + е ® восстановитель (реакция восстановления). Восстановитель – е ® окислитель (реакция окисления)
Пример окислительно-восстановительной реакции— горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:2H2 + O2 = 2H2O. Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония: NH4NO3 = N2O + 2H2O (до 250 °C).
2.4. Реакции нейтрализации – взаимодействие между веществами кислого и основного характера, с образованием нейтральных веществ (соли, воды): Na2O + CO2 → Na2CO3; ZnO + 2NaOH → Na2ZnO2 + H2O.
2.5. Ионнообменная реакция - обмен ионами между веществами, с образованием осадка (смотреть таблицу растворимости), газа, или слабого электролита (например, воды): Молекулярное уравнение Zn(OH)2 + Na2S → NaOH + Zn S↓
Полное ионное уравнение Zn+2 + 2OH- + Na+ + S-2 → Na+ + OH- + Zn S↓ Краткое ионное уравнение Zn+2 + S-2 → Zn S↓
2.6. Электрохимическая реакция – ОВР в электрическом поле, создаваемом электродами с выделением на электродах веществ. Электроды — проводники, соединённые с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
2.7. Основные закономерности электрохимического процесса: 1. Восстанавливаются на катоде металлы, стоящие в Электрохимическом ряду активности https://ru.wikipedia.org/wiki/ (ряд напряжений, стандартных электродных потенциалов) металлов до Тi: только из расплавов. Для менее активных металлов от Тi (включительно) до Pb- конкурирующие реакции, выделение водорода, и выделение металла в чистом виде одновременно. Не активные металлы, стоящие правее водорода легко разряжаются и восстанавливается только металл. 2. На аноде легко окисляются OH−, Cl−, Br−, I−, S2−. Тяжело окисляются (только из расплавов) PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F−. В водном растворе электролизу подвергается вода с выделением кислорода.
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→ Тi →Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→ H →Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
| Раствор соли активного металла и бескислородной кислотыNaCl ↔ Na++ Cl−K(-): 2H2O + 2e = H2+ 2OH−A(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2 Вывод: 2NaCl + 2H2O(электролиз) → H2+ Cl2+2NaOH Раствор соли менее активного металла и бескислородной кислоты ZnCl2↔ Zn2++ 2Cl−K"катод"(-): Zn2++ 2e = Zn0 A"анод"(+): 2Cl− — 2e = 2Cl0 Вывод: ZnCl2(электролиз) → Zn + Cl2 Раствор соли активного металла и кислородсодержащей кислоты Na2SO4↔2Na++SO42−K(-): 2H2O + 2e = H2+ 2OH−A(+): 2H2O — 4e = O2+ 4H+ Вывод: 2H2O (электролиз) → 2H2+ O2 | Расплав соли активного металла и бескислородной кислоты NaCl ↔ Na+ + Cl− K(-): Na+ + 1e = Na0 A(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2 Вывод: 2NaCl → (электролиз) 2Na + Cl2 Расплавгидроксида: активный металл и гидроксид-ион NaOH ↔ Na+ + OH− K(-): Na+ +1e =Na0 A(+): 4OH− −4e =2H2O + O2 Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2 Расплав соли активного металла и кислородосодержащей кислотыNa2SO4↔2Na++SO42−K(-): 2Na+ +2e =2Na0 A(+): 2SO42− −4e =2SO3+O2 Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2 |
ЕДС гальванического элемента ΔE = Eкатода - Eанода; E = E0 + [RT/(z*F)]*ln[C], где E0 – стандартный электродный потенциал, R = 8,31 Дж моль К, z – число электронов ОВР; F = 96485,34 Кл∙моль-1 С – молярная концентр., https://www.xumuk.ru/galvanopara/
Моль, молярная масса, молярная масса эквивалентов, основные законы общей химии
1. Моль. Молярная масса. Молярная масса эквивалента. Эквивалент.
2. Закон Авогадро: Следствия из закона Авогадро. Плотность одного газа по другому
3. Уравнение Клапейрона-Менделеева для идеальных газов.
4. Закон сохранения массы и энергии.
5. Закон постоянства состава: дальтониды, бертолиды.
6. Закон эквивалентов.
3.1. Моль n («ню») - количество вещества, которое содержит Авогадрово число (Число АвогадроNА=6,02 1023 моль-1) структурных единиц (молекул, атомов, ионов и др.). n = m/ М = N/ NА.
3.2. Молярная масса (М) – масса одного моля вещества, г/моль. Численно равна относительной молекулярной массе (Мr), показывающей во сколько раз масса молекулы, больше 1/12 массы атома углерода изотопа 12С, равной 1,66 10-27 кг (безразмерная). Например M (Сl2) = 70 г/моль; Mr (Сl2) = 70.
3.3. Молярная масса эквивалента Мэ = молярной массе вещества, поделенной на эквивалент э. Эквивалент (э) – реальная или условная частица вещества, которая в данной реакции реагирует с одним атомом или ионом водорода, или одним электроном (в ОВР): Н3РО4+3NаОН=Nа3РО4+ 3Н2О, Э= 3; Н3РО4+NаОН=NаН2РО4+ 3Н2О, Э = 1. Для кислот Э =основности, т.е. числу атомов Н; для оснований Э = числу гидроксильных групп ОН; для солей и оксидов Э = произведению числа атомов (металла) и валентности металла; для простых веществ Э = произведению числа атомов и валентности. Например: Э (H2SO4) = 2; Э (Аl(OH)3)= 3; Э (Аl2III(SO4)3) = 2 III = 6; Э (O2II) = 2 II = 4.
Мэ = ---, например: Мэ (H2SO4) = 98/2 = 49 г/моль,
э
3.4. Закон Авогадро: в равных объемах различных газов при од инаковых условиях (температура и давление) содержится одинаковое число молекул. Следствия из закона Авогадро: 1) При нормальных условиях н.у. (Т = 273,15 К, р = 1,01 Па) 1 моль любого газа занимает объем V0 = 22,4 л (молярный объем газа). n = v/ v0.
2) Плотность одного газа (x) по другому (y) равна отношению молярных масс этих газов Dy(x) = М x/Мy
Уравнение Клапейрона-Менделеева для идеальных газов в условиях отличных от н.у.:
РV = n RТ, где R- универсальная газовая постоянная = 8,31 Дж/моль К; Р - давление в Па; V – объем в м3; Т – температура в Кельвинах (К). Перевод давления в кПа через пропорцию:750 мм. рт.ст.= 1 атм = 101,3 кПа.
3.5 Закон сохранения массы и энергии: в изолированной системе сумма масс и энергий постоянна. Между массой и энергией существует взаимосвязь по уравнению Энштейна. Е = mс2.Закон сохранения массы: масса веществ, вступивших в реакцию, равна массе всех продуктов реакции (Ломоносов). Закон постоянства состава: каждое вещество, каким бы способом оно ни было получено, всегда имеет один и тот же качественный и количественный состав и свойства (дальтониды). Есть вещества исключения (бертолиды).
3.6. Закон эквивалентов: 1. Массы веществ в химическом превращении относятся друг к другу как же, как их молярные массы эквивалентов. 2. Массовые доли W элементов в сложном веществе относятся друг к другу как же, как их молярные массы эквивалентов.
m1 Мэ1
1) --- = ---
m2 Мэ2
W1 Мэ1
2) --- = ---
W2 Мэ2