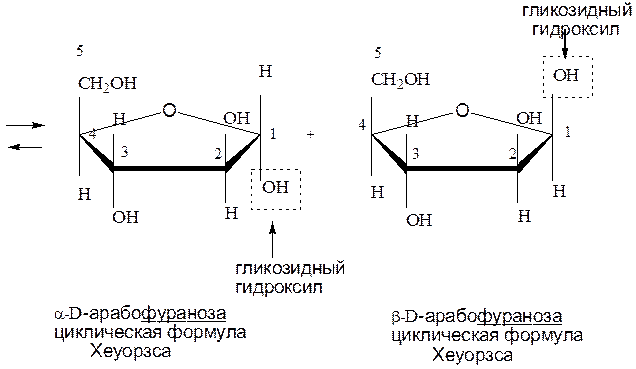Физические свойства
Моносахариды – бесцветные и в большинстве случаев кристаллические вещества. Хорошо растворимы в воде, умеренно – в уксусной кислоте, плохо – в спиртах и практически нерастворимы в растворителях невысокой полярности. Оптически активны (за исключением мезо-соединений).
Таутомерия моносахаридов
Таутомерия – способность соединения существовать одновременно в двух или нескольких взаимопереходящих формах. В случае моносахаридов – таутомерных форм пять (четыре циклических (Хеуорзса) и одна ациклическая (Фишера).
Доказательства существования циклических форм моносахаридов
1. Отсутствие некоторых реакций на альдегидную группу (например, с гидросульфитом натрия и фуксинсернистой кислотой).
2. Обладая оптической активностью, моносахариды подвергаются мутаротации. Мутаротация – изменение угла вращения свежеприготовленных растворов моносахаридов при стоянии. Т.е. угол вращения свежеприготовленного раствора моносахарида меняется некоторое время, пока не установится постоянное значение.
3. Количество оптических изомеров моносахаридов. Например, для гексозы (количество асимметрических атомов углерода равно 4), количество оптических изомеров должно быть равно 16. По формуле N = 2n, где N – количество оптических изомеров, n – количество асимметрических атомов углерода получается, что 24 = 16. На самом деле их 32.
4. Особые свойства одной из гидроксильных групп. Например, при алкилировании спиртами в кислой среде реакция протекает не по всем группам ОН, а только по одной.
Все эти несоответствия позволили сделать вывод о том, что моносахариды в растворе образуют помимо ациклической – циклические формы.
Объяснения несоответствий.
1. Преобладание циклических форм над ациклической в моносахариде (4 формы циклические против 1 ациклической) приводит к тому, что некоторые реакции по альдегидной группе незаметны. Так как в циклических формах нет альдегидной группы.
2. Явление мутаротации (изменение угла вращения свежеприготовленного раствора моносахарида) объясняется наличием в растворе не одной, а сразу 5 таутомерных форм, которых переходят друг в друга до тех пор, пока не установится равновесное состояние.
3. Удвоение количества изомеров по сравнению с теоретически расчитанным объясняется тем, что при переходе от ациклической к циклическим формам, появляется дополнительный асимметрический атом углерода. В нашем примере, становится не четыре, а пять асимметрических атомов углерода. И, следуя формуле расчета количества оптических изомеров, получаем 25 = 32.
4. Неравноценность гидроксильных групп в химическом отношении объясняется образованием гликозидного (полуацетального гидроксила). Гликозидный гидроксил – это группа ОН у первого атома углерода в цикле. Данная группа характерна только для циклических форм, образуется при переходе от ациклической к циклической форме и обладает повышенной реакционной способностью по отношению к другим группам ОН в молекуле моносахарида.
Таутомерия альдоз (пентоз) на примере D-арабинозы
Фуранозный цикл (часть 1)
При образовании фуранозного цикла замыкаем по окси и оксо группам 1-4 атомы углерода. Образуется переходная ациклическая форма Фишера - Толленса. Атом углерода оксогруппы становится асимметрическим, т.е. образуются две циклические формы. Образуется гликозидный гидроксил и, в зависимости от его расположения, образуется α или β-форма. Если гликозидный гидроксил и группа ОН, определяющая принадлежность моносахарида к D или L- ряду расположены по одну сторону от вертикальной составляющей в формуле Фишера – Толленса, то это α-форма; если по разные – то β-форма. α и β-изомеры – это аномеры. Аномеры – это оптические изомеры, отличающиеся расположением групп у первого атома углерода в цикле.
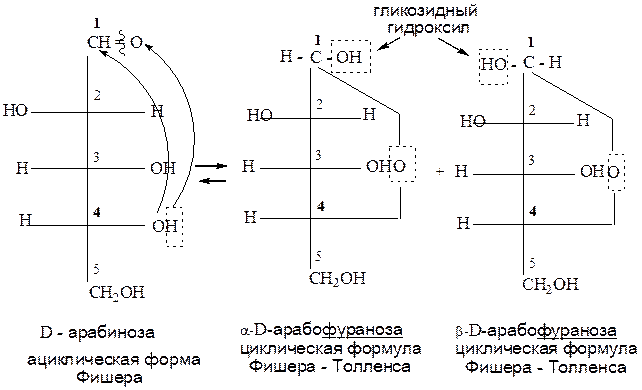
При дальнейшем переходе от формул Фишера – Толленса к формулам Хеуорзса все, что расположено слева от вертикальной составляющей попадает наверх, справа – вниз, кроме последнего атома углерода в цикле. Название соединений не меняется. α-форма, если гликозидный гидроксил сверху, β-форма, если гликозидный гидроксил снизу.