РАСЧЕТНЫЕ РАБОТЫ
по дисциплине «Неравновесные явления в сложных химических процессах»
для студентов, обучающихся по программе бакалавриата
по направлению подготовки 18.03.01 – Химическая технология,
19.03.01 – Биотехнология и 18.03.02 − Энерго- и ресурсосберегающие процессы
в химической технологии, нефтехимии и биотехнологии
Рассмотрены на заседании кафедры физической и коллоидной химии
_____________2016 г. Протокол № ____
Зав. кафедрой В.Ф. Марков
Рассмотрены на заседании УМС ХТИ
_____________2016 г. Протокол № ____
Председатель УМС ХТИ А.Б. Даринцева
Екатеринбург 2016
ВВЕДЕНИЕ
Данный сборник задач по курсу «Неравновесные явления в сложных химических процессах» предназначен для самостоятельной работы студентов Химико-технологического института и Института материаловедения и металлургии.
Предлагаемый сборник содержит 20 вариантов задач по названному курсу. Каждый вариант включает в себя 10 задач и предназначен для выполнения расчетных работ. Он охватывает все основные вопросы программы курса по химической кинетике и электрохимии неравновесных процессов.
Решение задач по названным разделам помогает студентам усвоить и глубже понять теоретические положения курса. К решению домашнего задания следует приступать только после самостоятельного ознакомления с соответствующими разделами курса или прослушав курс лекций по данному предмету.
Требования к оформлению расчетных работ:
1. Преподавателю сдается рукописный или распечатанный на принтере компьютерный файл расчетной работы, вариант которого указывается преподавателем.
2. В тексте расчетной работы приводится полное решение задач с указанием использованных формул и единиц измерения величин.
3. Графики выполняются на миллиметровой бумаге. При этом следует помнить:
− размер графика должен быть не менее четверти листа бумаги А4;
− масштабные единицы на осях координат отмечаются через равные интервалы;
− масштаб выбирается таким образом, чтобы от точки пересечения координат до их конца расстояние было немного больше, чем разность между наибольшими и наименьшими значениями координат точек;
− точки должны четко наноситься на график в соответствии с выбранным масштабом;
− точки соединяются плавной кривой таким образом, чтобы большинство из них попало на кривую или было в одинаковой мере удалено по обе стороны кривой.
Задача 1
Кинетика гомогенной реакции  описывается кинетическим уравнением второго порядка. Известна константа скорости и начальные концентрации исходных веществ (табл. 1). Выразите математически зависимость
описывается кинетическим уравнением второго порядка. Известна константа скорости и начальные концентрации исходных веществ (табл. 1). Выразите математически зависимость  и постройте кинетические кривые всех участников реакции в интервале времени от 0 до 60 мин с шагом 10 мин.
и постройте кинетические кривые всех участников реакции в интервале времени от 0 до 60 мин с шагом 10 мин.
Таблица 1
| № | 
| 
| 
| № | 
| 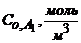
| 
|
| 0,00238 | 0,00240 | ||||||
| 0,00156 | 0,00220 | ||||||
| 0,00310 | 0,00267 | ||||||
| 0,00259 | 0,00316 | ||||||
| 0,00250 | 0,00400 | ||||||
| 0,00341 | 0,00220 | ||||||
| 0,00215 | 0,00365 | ||||||
| 0,00230 | 0,00236 | ||||||
| 0,00216 | 0,00259 | ||||||
| 0,00240 | 0,00312 |
Задача 2
Для гомогенной реакции, протекающей согласно стехиометрическому уравнению  , имеются данные по зависимости концентрации вещества А от времени (табл. 2). Постройте кинетическую кривую
, имеются данные по зависимости концентрации вещества А от времени (табл. 2). Постройте кинетическую кривую  . Определите графически по кинетической кривой, а также по зависимостям в соответствующих координатах (интегральным методом), к какому порядку - первому или второму - относится данная реакция и определите величину константы скорости реакции.
. Определите графически по кинетической кривой, а также по зависимостям в соответствующих координатах (интегральным методом), к какому порядку - первому или второму - относится данная реакция и определите величину константы скорости реакции.
Таблица 1
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 39,6 | 24,8 | 15,8 | ||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 16,4 | ||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 62,5 | 57,5 | |||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 13,8 | 8,7 | |||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 12,9 | 8,2 | |||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 7,4 | ||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 57,5 | 50,4 | |||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 31,5 | 12,5 | |||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 83,3 | 71,4 | |||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 24,5 | 9,4 | |||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 66,7 | ||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 89,3 | ||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| |||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| |||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| |||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| |||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| |||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| 26,6 | 16,4 | 6,2 | ||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
| |||||||||||||
| t, мин | |||||||||||||
 , моль/м3 , моль/м3
|
Задача 3
Для гомогенной реакции  дана зависимость концентрации вещества
дана зависимость концентрации вещества  от времени при начальных концентрациях А2 и А3,значительнопревышающих начальную концентрацию вещества A 1(табл. 3). Постройте кинетическую кривую
от времени при начальных концентрациях А2 и А3,значительнопревышающих начальную концентрацию вещества A 1(табл. 3). Постройте кинетическую кривую  и определите по ней дифференциальным методом частный порядок реакции по веществу А 1и эффективную константу скорости реакции.
и определите по ней дифференциальным методом частный порядок реакции по веществу А 1и эффективную константу скорости реакции.
Таблица 3
| 1. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 2. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 3. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 4. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 5. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 6. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 7. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 8. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 9. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 10. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 11. | t, мин | ||||||||
 , моль/м3 , моль/м3
| ПО | ||||||||
| 12. | t, мин | ||||||||
 , моль/м3 , моль/м3
| 66,5 | ||||||||
| 13. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 14. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 15. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 16. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 17. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 18. | t, мин | ||||||||
 , моль/м3 , моль/м3
| |||||||||
| 19. | t, мин | ||||||||
 , моль/м3 , моль/м3
| 24,5 | 3,3 | |||||||
| 20. | t, мин | ||||||||
 , моль/м3 , моль/м3
|
Задача 4
1. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® В + С + D дана зависимость давления газовой смеси от времени:
t, мин 0 5 10 15 20
p, Пa 40000 49800 58360 65870 72470
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
2. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® В + С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41000 46189 50710 54660 58115
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
3. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 0,5В + С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 42000 44475 46650 48573 50270
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
4. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 0,5В + 2С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 40000 48880 56440 62880 68370
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
5. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 0,5В + 1,5С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 44000 50504 56048 60770 64800
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
6. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® В + С +D дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41500 52380 62860 69998 77118
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
7. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® В + С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41000 46900 51940 56250 59950
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
8. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 0,5В + С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 42000 44750 47135 49200 51000
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
9. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А -> 0,5В + 2С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 40000 45720 50890 55560 59790
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
10. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 0,5В + 2С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 44000 49550 54410 58650 62360
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
11. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А® В + С +D дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41000 52100 61670 69950 77110
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
12. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® В + С +D дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 40500 50743 59680 67486 74307
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
13. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ®В + 0,5С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41000 43500 45700 47625 49316
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
14. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 0,5В + 2С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41000 66150 70260 73910 77140
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
15. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 1,5В + 0,5С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 43000 48616 53500 57746 61440
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
16. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® В + С +D дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41700 53346 63340 71943 79348
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
17. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А® В + С +D дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41700 52260 61460 69490 76520
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
18. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 0,5В + С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41000 43770 46166 48235 50026
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
19. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 0,5В + 2С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41000 65604 69280 72590 75574
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
20. Для реакции, протекающей в газовой фазе при постоянном объеме, согласно стехиометрическому уравнению А ® 0,5В + С дана зависимость общего давления газовой смеси от времени:
t, мин 0 5 10 15 20
р, Па 41000 66150 70260 73910 77140
Полагая, что реакция описывается уравнением первого порядка, выразите константу скорости реакции через общее давление и рассчитайте ее величину.
Задача 5.
1. Реакция изомеризации b-оксикротонового эфира (А)в ацетоуксусный эфир (В)относится к мономолекулярным реакциям ( )
) 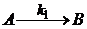 ;
;  . По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую
. По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую  . Найдите константы скорости прямой и обратной реакции.
. Найдите константы скорости прямой и обратной реакции.
t, час 0 100 200 300 400 500 ¥
 , моль/м3 366 250 184 139 117 103 78
, моль/м3 366 250 184 139 117 103 78
2. При 1300 К возможно протекание бимолекулярной параллельной реакции
 .
.
Известно, что начальная концентрация окиси азота  4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 30%?
4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 30%?
3. Превращение роданистого аммония (А)в тиомочевину (В)является мономолекулярной реакцией 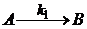 ,
,  . Известна зависимость концентрации роданида аммония от времени (
. Известна зависимость концентрации роданида аммония от времени ( ). Постройте кинетическую кривую
). Постройте кинетическую кривую  и определите константы скоростей прямой и обратной реакций.
и определите константы скоростей прямой и обратной реакций.
t, мин 0 6 25 44 54 66 ¥
сА, моль/м3 1000 980 810 620 520 400 212
4. Реакция изомеризации b-оксикротонового эфира (А)в ацетоуксусный эфир (В)относится к мономолекулярным реакциям ( )
) 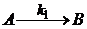 ;
;  . По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую
. По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую  . Найдите константы скорости прямой и обратной реакции.
. Найдите константы скорости прямой и обратной реакции.
t, час 0 50 150 250 350 450 ¥
сА, моль/м3 366 300 212 158 125 110 78
5. При 1300 К возможно протекание бимолекулярной параллельной реакции
 .
.
Известно, что начальная концентрация окиси азота  4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 32%?
4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 32%?
6. Превращение роданистого аммония (А)в тиомочевину (В)является мономолекулярной реакцией 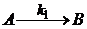 ,
,  . Известна зависимость концентрации роданида аммония от времени (
. Известна зависимость концентрации роданида аммония от времени ( ). Постройте кинетическую кривую
). Постройте кинетическую кривую  и определите константы скоростей прямой и обратной реакций.
и определите константы скоростей прямой и обратной реакций.
t, мин 0 6 25 44 54 66 ¥
сА, моль/м3 900 882 729 558 468 360 190,8
7. Реакция изомеризации b-оксикротонового эфира (А)в ацетоуксусный эфир (В)относится к мономолекулярным реакциям ( )
) 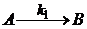 ;
;  . По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую
. По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую  . Найдите константы скорости прямой и обратной реакции.
. Найдите константы скорости прямой и обратной реакции.
t, час 0 75 175 275 375 475 ¥
сА, моль/м3 366 275 197 149 120 107 78
8. При 1300 К возможно протекание бимолекулярной параллельной реакции
 .
.
Известно, что начальная концентрация окиси азота  4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 40%?
4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 40%?
9. Превращение роданистого аммония (А)в тиомочевину (В)является мономолекулярной реакцией 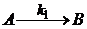 ,
,  . Известна зависимость концентрации роданида аммония от времени (
. Известна зависимость концентрации роданида аммония от времени ( ). Постройте кинетическую кривую
). Постройте кинетическую кривую  и определите константы скоростей прямой и обратной реакций.
и определите константы скоростей прямой и обратной реакций.
t, мин 0 6 25 44 54 66 ¥
сА, моль/м3 950 931 769 589 494 380 201,4
10. Реакция изомеризации b-оксикротонового эфира (А)в ацетоуксусный эфир (В)относится к мономолекулярным реакциям ( )
) 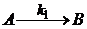 ;
;  . По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую
. По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую  . Найдите константы скорости прямой и обратной реакции.
. Найдите константы скорости прямой и обратной реакции.
t, час 0 60 160 260 360 460 ¥
сА, моль/м3 366 290 205 155 122 108 78
11. При 1300 К возможно протекание бимолекулярной параллельной реакции
 .
.
Известно, что начальная концентрация окиси азота  4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 35%?
4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 35%?
12. Превращение роданистого аммония (А)в тиомочевину (В)является мономолекулярной реакцией 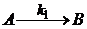 ,
,  . Известна зависимость концентрации роданида аммония от времени (
. Известна зависимость концентрации роданида аммония от времени ( ). Постройте кинетическую кривую
). Постройте кинетическую кривую  и определите константы скоростей прямой и обратной реакций.
и определите константы скоростей прямой и обратной реакций.
t, мин 0 6 25 44 54 66 ¥
сА, моль/м3 1020 999,6 826 632 530 408 216,2
13. Реакция изомеризации b-оксикротонового эфира (А)в ацетоуксусный эфир (В)относится к мономолекулярным реакциям ( )
) 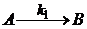 ;
;  . По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую
. По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую  . Найдите константы скорости прямой и обратной реакции.
. Найдите константы скорости прямой и обратной реакции.
t, час 0 80 180 280 380 480 ¥
сА, моль/м3 366 271 195 146 120 105 78
14. При 1300 К возможно протекание бимолекулярной параллельной реакции
 .
.
Известно, что начальная концентрация окиси азота  4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 45%?
4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 45%?
15. Превращение роданистого аммония (А)в тиомочевину (В)является мономолекулярной реакцией 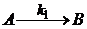 ,
,  . Известна зависимость концентрации роданида аммония от времени (
. Известна зависимость концентрации роданида аммония от времени ( ). Постройте кинетическую кривую
). Постройте кинетическую кривую  и определите константы скоростей прямой и обратной реакций.
и определите константы скоростей прямой и обратной реакций.
t, мин 0 6 25 44 54 66 ¥
сА, моль/м3 980 960 794 608 510 392 207,8
16. Реакция изомеризации b-оксикротонового эфира (А)в ацетоуксусный эфир (В)относится к мономолекулярным реакциям ( )
) 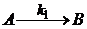 ;
;  . По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую
. По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую  . Найдите константы скорости прямой и обратной реакции.
. Найдите константы скорости прямой и обратной реакции.
t, час 0 90 190 290 390 490 ¥
сА, моль/м3 366 300 212 158 125 110 78
17. При 1300 К возможно протекание бимолекулярной параллельной реакции
 .
.
Известно, что начальная концентрация окиси азота  4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 55%?
4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 55%?
18. Превращение роданистого аммония (А)в тиомочевину (В)является мономолекулярной реакцией 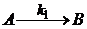 ,
,  . Известна зависимость концентрации роданида аммония от времени (
. Известна зависимость концентрации роданида аммония от времени ( ). Постройте кинетическую кривую
). Постройте кинетическую кривую  и определите константы скоростей прямой и обратной реакций.
и определите константы скоростей прямой и обратной реакций.
t, мин 0 6 25 44 54 66 ¥
сА, моль/м3 930 911,4 753 577 484 372 197,2
19. Реакция изомеризации b-оксикротонового эфира (А)в ацетоуксусный эфир (В)относится к мономолекулярным реакциям ( )
) 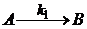 ;
;  . По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую
. По зависимости концентрации b-оксикротонового эфира от времени постройте кинетическую кривую  . Найдите константы скорости прямой и обратной реакции.
. Найдите константы скорости прямой и обратной реакции.
t, час 0 100 200 300 400 500 ¥
сА, моль/м3 366 250 184 139 117 103 78
20. При 1300 К возможно протекание бимолекулярной параллельной реакции
 .
.
Известно, что начальная концентрация окиси азота  4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 55%?
4000 моль/м3, а константы скоростей равны, соответственно, k1 = 0,0257 м3моль-1с-1, k2 = 0,0182 м3моль-1с-1. Через какое время от начала реакции концентрация окиси азота уменьшится на 55%?
Задача 6
Последовательная реакция первого порядка протекает при 298 К по схеме А ® В ® D. Константы скорости стадий 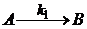 ,
,