Аминокислоты. Белки.
Вопросы экзамена
1. Аминокислоты. Классификация аминокислот. Номенклатура. Строение. Получение.
2. Химические свойства аминокислот: реакции карбоксильной группы, реакции аминогруппы. Отношение к нагреванию. Пептидная связь. Применение в медицине.
Белки - высокомолекулярные соединения, молекулярная масса которых лежит в широком диапазоне и может достигать нескольких миллионов.
Белки и пептиды построены из остатков α-аминокислот.
Свойства белков во многом определяются строением и химическим поведением α-аминокислот.
Многие белки и пептиды применяются как лекарственные средства, это ферменты, гормоны, антибиотики, сыворотки.
Природные α-аминокислоты
В настоящее время известно свыше 100 природных α-аминокислот, из которых только 20 входят практически во все белковые молекулы (табл. 1).
12 из них могут синтезироваться в организме человека- заменимые, а 8-незаменимые не синтезируются, поступают с пищей.
Аминокислоты — органические бифункциональные амфотерные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы -NH2.
Простейший представитель — аминоуксусная кислота H2N-CH2-COOH (глицин)
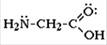
α-Аминокислоты имеют общую формулу:
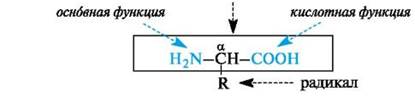
· и различаются только строением радикала R.
· Обе функциональные группы в молекуле - аминогруппа и карбоксильная группа - находятся у одного и того же атома углерода.
Классификация и номенклатура
α-Аминокислоты классифицируют в зависимости от следующих признаков:
· По характеру радикала различают алифатические, ароматические и гетероциклические аминокислоты (см. табл.1).
Группа алифатических аминокислот наиболее многочисленна.
К ароматическим относят две аминокислоты, к гетероциклическим - три.
• В зависимости от количества функциональных групп различают кислые, нейтральные и основные.
Белковые α-аминокислоты*
| Глицин(аминоуксусная) 2 -аминоэтановая Серин (2 амино–3 гидроксипропановая) Лизин ** 2,6 ди – аминогексановая Цистеин (2-амино-3-тиопропановая) Фенилаланин ** 2 амино 3 – фенилпропановая Триптофан (β-(β-индолил)-α-аминопропионовая кислота | 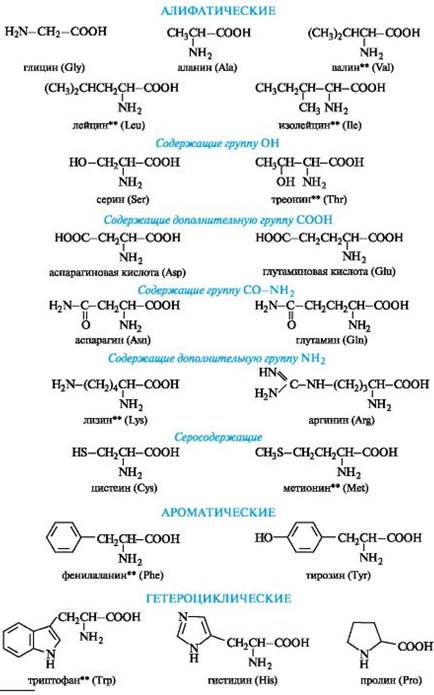
| Аланин(α -аминопропионовая) Глутаминовая 2 аминопентан диовая Тирозин β-(пара-оксифенил)-α-аминопропионовая Гистиди́н (L-α-амино-β-имидазолил пропионовая кислота) Проли́н (пирролидин-α-карбоновая кислота) |
* Сокращенные обозначения применяются только для записи аминокислотных остатков в молекулах пептидов и белков.
** Незаменимые аминокислоты.
В номенклатуре белковых аминокислот прочно привились тривиальные названия, признанные номенклатурой ИЮПАК (см. табл..1).
Систематические названия α-аминокислот практически не используются, хотя они, безусловно, допустимы.
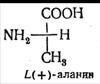
Оптическая изомерия
Стереоизомерия α-аминокислот, кроме глицина, связана с тем, что α-углеродный атом связан с четырьмя разными заместителями, поэтому все эти аминокислоты могут существовать в виде двух изомеров (энантиомеров), являющихся зеркальными отражениями друг друга (оптическая изомерия).
В состав белков животных организмов входят только L-аминокислоты.
Оптические изомеры аланина
 Например:
Например: 
ФИЗИЧЕСКИЕ СВОЙСТВА
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований.
Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус.
Эти свойства отчётливо указывают на солеобразный характер этих соединений.
Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной. α-аминокислоты являются амфотерными электролитами.
ПОЛУЧЕНИЕ α –АМИНОКИСЛОТ
1. Из карбоновых кислот по схеме – важнейший способ:
CH3COOH + Cl2 (Ркр) à CH2Cl -COOH
Уксусная кислота хлоруксусная
Cl – СН2 – СООН + NH3 → NH2–СН2 – СООН + HCl
хлоруксусная кислота аминоуксусная к-та (глицин)