Производные алканов, в молекулах которых один или несколько атомов водорода замешены атомами галогенов — фтора, хлора, брома или иода, называют галогеналканами.
Классификация и номенклатура
В зависимости от типа атома углерода, связанного с галогеном, галогенал-каны классифицируют как первичные, вторичные и третичные, по числу атомов галогена в молекуле различают моно-, ди- и полигалогенпроизводные. Ниже даны примеры названий галогеналканов по номенклатуре ИЮПАК. Для низших галогенпроизводных указаны названия и по радикало-функциональной номенклатуре (эти названия даны в скобках).
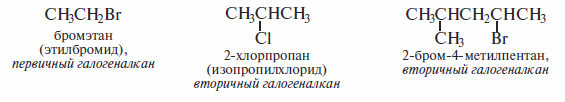
Способы получения
Галогенирование алканов
Галогенирование алканов — наиболее распространенный способ получения бром- и хлоралканов. Реакция хлорирования протекает с невысокой региоселективностью
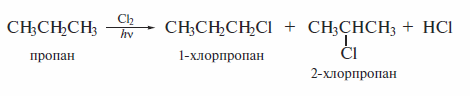
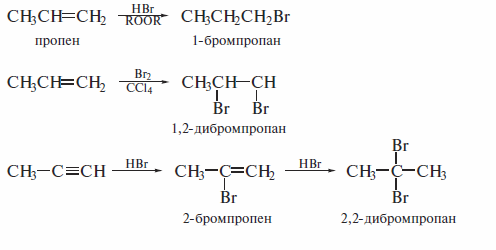
Галогенирование и гидрогалогенированиеалкенов и алкинов
По сравнению с галогенированием алканов реакции галогенирования и гилрогалогенированияалкенов и алкинов отличаются большей региоселек-тивностью
Замещение гидроксигруппы на галоген в спиртах
Этот способ имеет значительное распространение в лабораторной практике
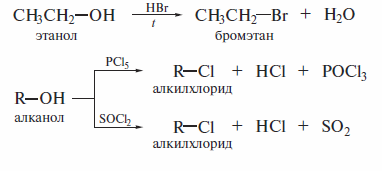 Физические свойства
Физические свойства
Физические свойства галогенопроизводных зависят от природы галогена, состава и строения углеводородного радикала. При обычных условиях фтористые метил, этил, пропил и бутил, хлористые метил и этил, бромистый метил являются газами. Все остальные га-логеналкилы — жидкости, высшие представители — твердые вещества. Температура кипения галогеиалкилов с одинаковым углеродным скелетом возрастает от фтористых к йодистым алкилам; при одном и том же числе углеродных атомов температура кипения ниже всего у третичных галогеиалкилов. Плотность галогеиалкилов возрастает при переходе от фтористых к йодистым. Низшие галогеналкилы обладают сладковатым запахом. Они практически нерастворимы в воде, но хорошо растворяются в органических растворителях и сами являются растворителями.
Электронное строение
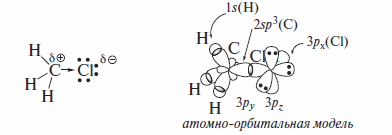
Атомы галогенов более электроотрицательны, чем углерод, поэтому связи Сsp3-Halполярны. Характеристики связей С-Hal приведены ниже поданным для галогенметанов, и на примере метилхлорида СН3С1 показаны два способа изображения электронной структуры галогеналкана. Структурная формула иллюстрирует электроноакцепторный эффект хлора и появление дробных зарядов на атомах углерода и хлора, а атомно-орбитальная модель показывает, какие орбитали формируют ковалентные связи в молекуле галогеналкана.
Изменение полярности (мера полярности — дипольный момент) и поляризуемости связей Сsp3-Х (где X — галоген) в зависимости от природы атома галогена, а также другие характеристики связей С-Hal в галоген-метанах иллюстрируют данные табл. (в качестве меры поляризуемости указана рефракция связи). Видно, что в ряду С-F, С-CI, С-Вг, С-I длина связи С-Hal увеличивается, повышается ее поляризуемость, а следовательно, снижается прочность.
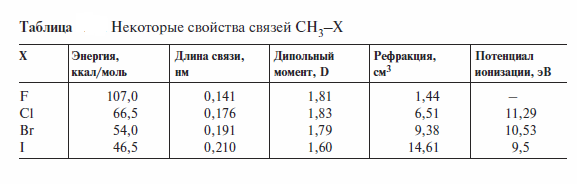
Значительная полярность связи С-Hal объясняют склонностьгалоген-производных к реакциям нуклеофильного замещения.
Химические свойства
Реакции с нуклеофилами — наиболее распространенные превращения га-логенатканов. Их важность определяется тем, что именно эти реакции позволяют вводить в органические соединения самые разнообразные функциональные группы. Ниже в качестве примера перечислены некоторые превращения этилбромида:
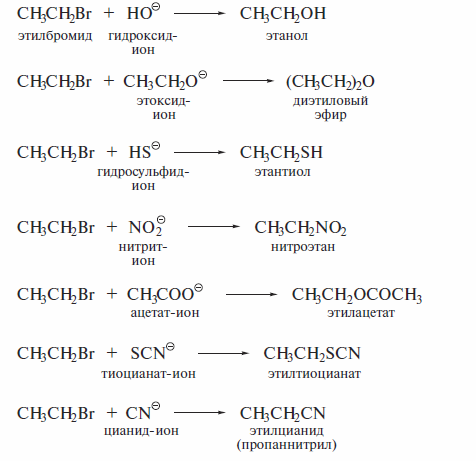
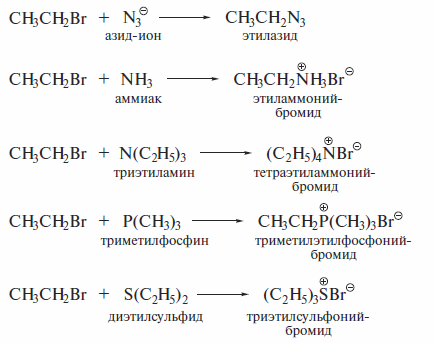
Все перечисленные реакции идут по типу нуклеофильного замещения у алифатического атома углерода. Кроме атомов галогена в галогеналканах, замещению в различных субстратах под действием нуклеофильных реагентов могут подвергаться и другие функциональные группы.
В самом общем виде реакции нуклеофильного замещения у sp3 -гибриди-зованного атома углерода представляют следующей схемой:
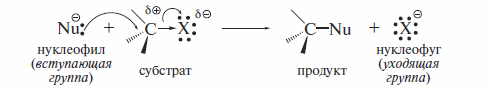
Согласно этой схеме, нуклеофил Nu: со своей электронной парой замешает в субстрате группу X, уходящую с электронной парой в виде аниона. К нуклеофильным реагентам относят все атомы или молекулы, которые являются донорами электронной пары при образовании связи с любым элементом, кроме водорода. Нуклеофильные реагенты различаются по признаку наличия или отсутствия у них отрицательного заряда (показаны лишь отдельные представители соответствующих нуклеофилов):• нуклеофилы — отрицательно заряженные ионы 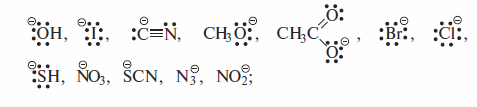
• нуклеофилы — нейтральные молекулы
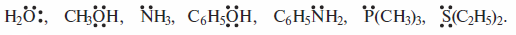
Реакции нуклеофильного замещения у алифатического атома углерода являются не только одними из самых распространенных в органической химии. Эти реакции также и наиболее изучены с точки зрения механизма. Чаше всего они протекают по одной из двух схем:
1) бимолекулярное нуклеофильное замещение (SN2);
2) мономолекулярное нуклеофильное замещение (SN1)
Бимолекулярное нуклеофильное замещение
Реакции SN2 протекают при действии на субстраты сильных нуклеофиль-ных реагентов. Одним из характерных примеров реакции SN2 является щелочной гидролиз метилбромида:
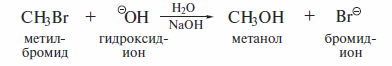
В этой реакции гилроксид-ион (вступающая группа, нуклеофил) замешает анион брома (уходящая группа, нуклеофуг) в молекуле метилбромида (субстрат).
Механизм реакции S N 2
Скорость реакции SN2 описывается кинетическим уравнением второго порядка:
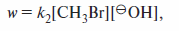
т. е. пропорциональна концентрации субстрата и нуклеофила.
В переходном состоянии скоростьлимитирующей стадии гидролиза ме-тилбромида участвуют две частицы: гидроксид-ион и метилбромид.
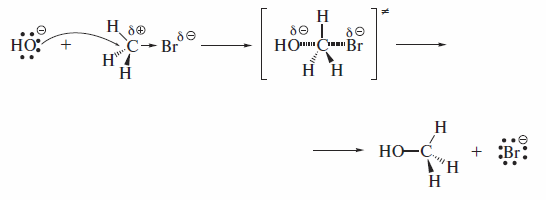
Гидроксид-ион атакует атом углерода, имеющий частичный положительный заряд, со стороны, противоположной атому брома, т. е. «с тыла». Образование связи С-О и разрыв связи С-Вг в переходном состоянии происходят одновременно.
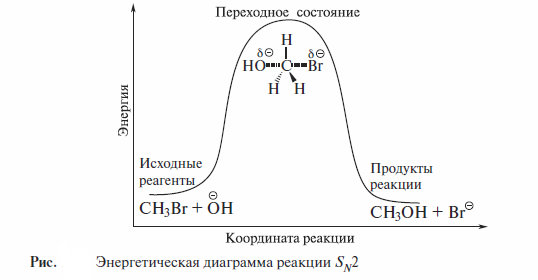
Переходное состояние можно представить как активированный комплекс, в котором атом углерода частично связан со вступающей группой, а связь С—Вг с уходящей группой еще не вполне разорвалась. Отрицательный заряд распределен между вступающей и уходящей группами. При этом атом углерода остается незаряженным. Таким образом, реакция протекает как одностадийный синхронный процесс. Этот механизм объективно отражается энергетической диаграммой, представленной на рисунке.
Мономолекулярное нуклеофильное замещение
Реакции мономолекулярного нуклеофильногозамещения(SN1) принципиально отличаются от реакций SN2.Реакции SN1 часто протекают при действии на соответствующие субстраты слабыми нуклеофильными реагентами, но в растворителях, обладающих высокой ионизирующей способностью. Такие растворители, как правило, и выступают в качестве нуклеофилов. Например, при использовании в качестве растворителя воды или спиртов протекают реакции гидролиза или алкоголиза соответственно.
По механизму SN1, в частности, протекает гидролиз трет -бутилбромида. Эта реакция обратима. Сдвигу равновесия вправо способствует избыток воды.

Механизм реакции SN1
Реакции SN1 описываются кинетическим уравнением первого порядка:
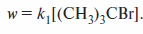
Скорость реакции не зависит от концентрации нуклеофила. Однако реакция SN1может рассматриваться как мономолекулярная только формально.На самом деле нуклеофильный реагент не участвует в скоростьлимитирующей стадии. Вместе с тем скорость реакции в значительной мере определяется ионизирующей способностью растворителя, и таким образом его молекулы участвуют в скоростьлимитирующей стадии.
В механизме реакции SN1 различают следующие стадии.
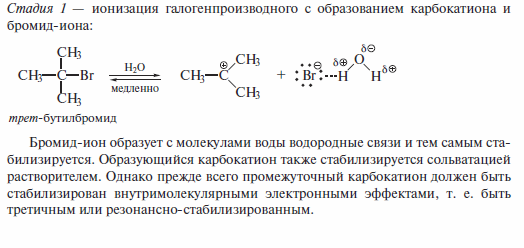
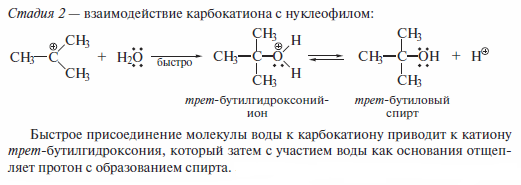
Стадия I является скоростьлимитируюшей, она характеризуется более высокой энергией активации.
Элиминирование (отщепление)
Как мы видели, третичные галогеналканы не способны к реакциям бимолекулярного нуклеофильного замещения (SN2). Однако если нуклео-фильный реагент яааяется сильным основанием, то от молекулы галогенал-кана отщепляется (реакция Е— реакция элиминирования) галогеноводород. Например, при обработке трет-бутилбромида водным раствором щелочи наблюдается реакция дегидробромирования:
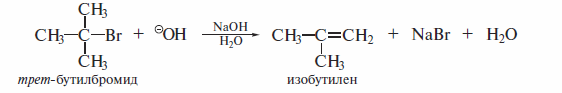
Реакции отщепления, в которых уходящие группы — анион галогена и протон — отщепляются от соседних атомов углерода с образованием π-свя-зи между ними, называют β-элиминированием:
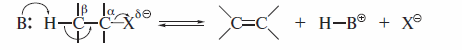
Реакции элиминирования, приводящие к алкенам, являются наиболее важными реакциями отщепления. Аналогично реакциям нуклеофильного замещения реакции элиминирования протекают по двум механизмам: E2 и E1. Реакции E2 протекают при действии на галогеналканы сильными основаниями. Часто применяют спиртовый раствор КОН, который содержит высокоосновный реагент этоксид-ион.
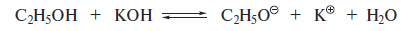
Основания, применяемые в реакциях E2, располагаются по силе в следующей последовательности:
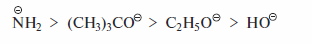
Реакции Е2 часто конкурируют с реакциями SN2, так как основание может выступать и в качестве нуклеофила:
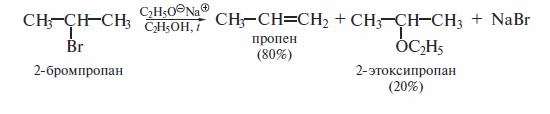
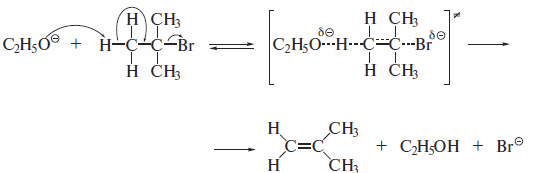
Реакция являетсяE2 бимолекулярной, т. е. в медленной стадии реакции участвуют галогеналкан и основание. Она представляет собой одностадийный согласованный процесс р-элиминирования, протекающий через переходное состояние, в котором разрыв связей Сα-X и Сβ-Н и образование π-связи происходят одновременно
Реакции р-элиминирования галогеналканов, имеющих в молекуле две не-эквивалентные С-Н-связи, способные к разрыву, приводят к образованию смеси двух алкенов:
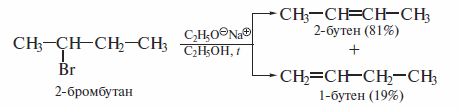
Эти реакции протекают в соответствии с правилом Зайцева.
Протон отщепляется преимущественно от наименее гидрогенизированного Сβ-атома с образованием наиболее замещенного при двойной связи алкена.
Галогеналкены
Различают две группы галогеналкенов. Представители этих групп различаются взаимным расположением двойной связи и атома галогена.
Галогенпроизволныесо связью Сsp3-Х
К этой группе соединений относят галогенпроизводные аллильного типа. В этих соединениях двойная связь и атом галогена разделены двумя простыми связями. Ниже приведены названия соединений по номенклатуре ИЮПАК.
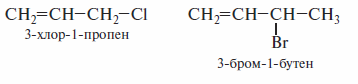
К этой же группе относятся галогеналкены, в которых двойная связь и атом галогена разделены более чем двумя простыми связями, как, например, в4-хлор-1-бутене.
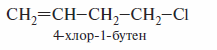
Галогенпроизводные со связью Сsp2-Х
К этой группе соединений относят винилгалогениды. Вэтих галогенпроизводных атом галогена непосредственно связан с sр3-гибридизованным атомом углерода.
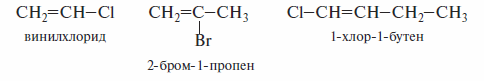
Реакции галогенидов этой группы отличаются значительным своеобразием и, в частности, крайне низкой подвижностью атома галогена в процессах нуклеофильного замещения.
Получение аллилгалогенидов
Галогеналкены, содержащие атомы хлора или брома у Сsp3-атома в α-положении к двойной связи, получают аллильным галогенированием:
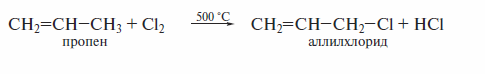
Получение винилгалогенидов
Винилгалогениды получают взаимодействием алкинов с галогенами и гало-геноводородами:
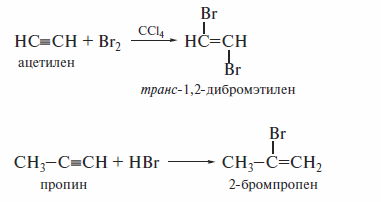
Важный в промышленном отношении винилхлорид получают оксихло-рированием этилена
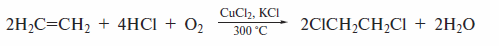
и последующим термолизом 1,2-дихлорэтана
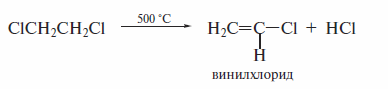
Электронное строение
Как видно из данных табл., связи Сsp2 -Cl укорочены и менее полярны, а следовательно, и более прочны по сравнению со связями Сsp3-С1. То же самое относится и к связям атомов углерода с другими галогенами.
Причиной упрочения связи Csp2-X является наличие сопряжения р-ор-биталинеподеленной электронной пары галогена (НЭП) и π-орбиталей двойной углерод-углеродной связи. Далее показаны электронные эффекты в винил-хлориде.
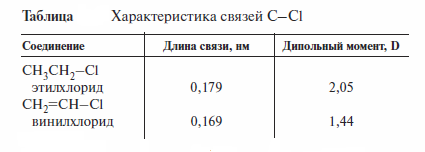
В терминах гибридизации атомных орбиталей показана возможность pπ-pπсопряжения НЭП галогена и π-связи:
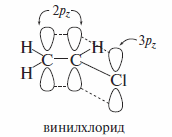
В терминах электронных эффектов показаны индуктивный эффект галогена и эффект сопряжения:
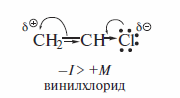
В терминах теории резонанса ниже показан эффект сопряжения с участием НЭП галогена:
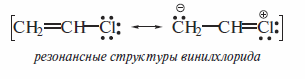
В полном согласии с отмеченными выше характеристиками связей Сsp2- Halвинилгалогениды проявляют пониженную реакционную способность в реакциях, протекающих с разрывом этих связей.
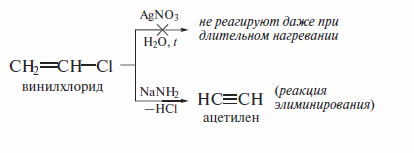
Реакции винилгалогенидов
Характерной особенностью винилгалогенидов является их инертность в реакциях как SN1-, так и SN2-типа. Реакции винилгалогенидов с обычными нуклеофильными реагентами не идут. При повышении температуры в присутствии сильных оснований протекают реакции элиминирования, присоединения и полимеризации.
В случае галогенопроизводных второй группы(галогенпроизводные со связью Сsp3-Х)атом галогена легко замещается. Это объясняется большой устойчивостью (благодаря сопряжению) карбениевого иона, возникающего при диссоциации галогенопроизводного типа:
