Тема: Способы отображение химического состава воды (2 часа)
Цель работы: знакомство со способами отображения химического состава природных вод; выработка умения отображения и определения гидрохимического состава водных объектов.
Ход работы.
Наиболее распространенные методы отображения гидрохимического состава природных вод – с помощью формулы Курлова и графически.
I. Прием наглядного изображения химического состава природных вод, предложенный М. Г. Курловым. Ф. К- представляет собой псевдодробь, в числителе которой располагаются анионы (в процентах по отношению к количеству вещества эквивалента) в порядке убывания их содержания, в знаменателе — в таком же порядке катионы. Первоначально ионы, содержание которых было менее 10 %, в формуле не указывались. Слева от формулы приводилось содержание газов (г/дм3), символы специфических компонентов и минерализация воды, обозначенная буквой М. Справа от дроби указывались водородный показатель (рН), температура воды (°С), расход воды источника или дебит скважины (м3/сут), например:
FeO,015CO22M6 HCO360 CL40 рН6,9 Т °С25 D150.
Na90 Ca10 *
Формула Курлова. неоднократно усовершенствовалась И. Ю. Соколовым, О. А. Алекиным, У. М. Ахмедсафиным и Ж. Сыдыковым и др. В результате этих видоизменений в Ф. К. теперь показываются все анионы и катионы, концентрация которых превышает 1 % количества вещества эквивалента.Один из вариантов изображения химического состава воды в виде Ф. К. И. Ю. Соколов назвал «формулой вещественного состава воды»; формула имеет вид
СОа 1080 FeO,002 М 1.0/18,42 HCO389 SO48 CL12 F1 pH 6,3 Eh100 Т°С40.
Na55 Ca30 Mgl4 Kl '
У. М. Ахмедсафин и Ж. Сыдыков предложили ввести в Ф.' К. значения абсолютной концентрации главных ионов (г/дм3), оставив при этом и значения, выраженные в процентах количества вещества эквивалента. Для удобства показа концентрации и относительного состава они применили условные символы, предложенные Алекиным: карбонатные и гидрокарбонатные ионы обозначаются через С, сульфатные — через S, хлоридные — через С1 и т. д. По модификации указанных автором Ф. К. для воды Александровско-Ермолинского источника в г. Пятигорске будет иметь вид
СО21,0 H2 S0,01 М5,0 CL201,06 C181,61 S110,82 Т°С46 D738 •
Na301,02 Ca150,45 Mg50,03
Формула Курлова, записанная по этому способу, позволяет полнее отразить все важнейшие характеристики химического состава воды - относительный химический состав воды и концентрацию всех компонентов этого состава.
Задача 1. Составить три варианта формулы химического состава воды для водоема с гидрохимическими показателями: среднегодовая температура воды - +24оС, рН – 5,5, дебет– 412 м3/сек, элементарный состав
| Na+ | K+ | Mg2+ | Ca2+ | Fe2+ | Cu2+ | Cs+ | Ba2+ | Ag+ | HCO3- | SO42- | CL- | NO3- | Br- | B3- | SO2 | HF |
| 2,36 | 0,7 | 0,9 | 3,55 | 0,08 | 0,03 | 0,04 | 0,03 | 0,006 | 3,60 | 1,97 | 0,96 | 0,88 | 0,009 | 0,01 | 0,09 | 0,07 |
II. Графическое изображение результатов химического анализа воды – этоспособ наглядного выявления сходства или различия химического состава природных вод. Графические способы могут применяться главным образом для первичной обработки результатов химического анализа большого числа проб природных вод.
Для графического изображения результатов анализа воды с учетом раздельного содержания Са2+ и Mg2+, а также SO42- и С1- пользуются треугольником Фере (рис. 2). Один из треугольников служит для изображения анионов, другой — катионов. В каждом треугольнике по данным о количестве вещества эквивалента в процентах наносится точка, отвечающая данному составу воды. К.В. Филатов предложил соединить оба треугольника и пользоваться образовавшимся ромбом. Построения те же.
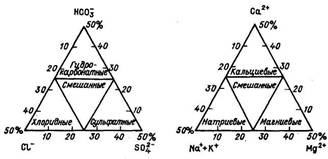 Примером более сложных графиков может служить графическая интерпретация классификации О.А. Алекина, предложенная В.П. Дорошенко. Она состоит из трех основных элементов — двух треугольников Фере и трапеции типов природных вод, объединенных в одну систему графиков. Кроме того, есть вспомогательный элемент — ромб, который выполняет роль связующего звена между треугольниками Фере. График-трапеция основан на характерных соотношениях ионов по классификации Алехина, определяющих типы природных вод, которые для данных целей представлены количеством вещества эквивалента в процентах и выражены через два аргумента: [Na+ + HCO3-] и [SO42-].
Примером более сложных графиков может служить графическая интерпретация классификации О.А. Алекина, предложенная В.П. Дорошенко. Она состоит из трех основных элементов — двух треугольников Фере и трапеции типов природных вод, объединенных в одну систему графиков. Кроме того, есть вспомогательный элемент — ромб, который выполняет роль связующего звена между треугольниками Фере. График-трапеция основан на характерных соотношениях ионов по классификации Алехина, определяющих типы природных вод, которые для данных целей представлены количеством вещества эквивалента в процентах и выражены через два аргумента: [Na+ + HCO3-] и [SO42-].
Рисунок 2 – Треугольная форма диаграмм (анионы и катионы)
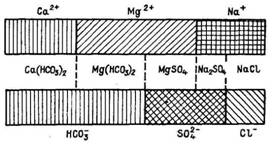 III. Примером графического способа изображения результатов химического анализа воды может служить график Роджерса (рис. 3), имеющий вид двух вертикальных или горизонтальных столбиков, на одном из которых нанесены в масштабе количества вещества эквивалентов анионов, а на другом — количества вещества эквивалентов катионов в последовательности, определяемой реакционной способностью НСО3-, SO42-, Cl- и Са2+, Mg2+, Na+. Проектирование значений катионов на столбик значений анионов указывает на наличие солей, растворенных в воде.
III. Примером графического способа изображения результатов химического анализа воды может служить график Роджерса (рис. 3), имеющий вид двух вертикальных или горизонтальных столбиков, на одном из которых нанесены в масштабе количества вещества эквивалентов анионов, а на другом — количества вещества эквивалентов катионов в последовательности, определяемой реакционной способностью НСО3-, SO42-, Cl- и Са2+, Mg2+, Na+. Проектирование значений катионов на столбик значений анионов указывает на наличие солей, растворенных в воде.
РРисунок 3 – График Роджерса
Однако при всей своей наглядности эти способы не могут обнаружить солей, реально существующих в растворе и, что особенно важно, они неточны и как генетические приемы для выяснения происхождения химического состава воды.
Задача 2. Построить графики химического состава водоема способами Фере и Роджерса с использованием данных задания 1. Сделать вывод о гидрохимическом типе воды; о совпадении результатов всех построений и химической формулы при анализе гидрохимического типа воды.
Классификация природных вод О.А. Алехина
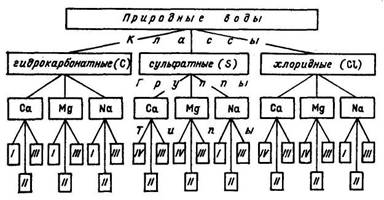 Наиболее часто применяемая в настоящее время классификация природных вод, сочетающая принцип деления химического состава воды по преобладающим ионам с делением по количественному соотношению между ними. Преобладающими считаются ионы с наибольшим относительным содержанием в процентах в пересчете на количество вещества эквивалента. По преобладающему аниону природные воды делятся на три класса:
Наиболее часто применяемая в настоящее время классификация природных вод, сочетающая принцип деления химического состава воды по преобладающим ионам с делением по количественному соотношению между ними. Преобладающими считаются ионы с наибольшим относительным содержанием в процентах в пересчете на количество вещества эквивалента. По преобладающему аниону природные воды делятся на три класса:
1) гидрокарбонатных и карбонатных вод (большая часть маломинерализованных вод рек, озер, водохранилищ и некоторые подземные воды);
2) сульфатных вод (промежуточные между гидрокарбонатными и хлоридными водами, генетически связаны с различными осадочными породами);
3) хлоридных вод (высокоминерализованные воды океана, морей, соленых озер, подземные воды закрытых структур и др.).
Каждый класс по преобладающему катиону подразделяется на три группы: кальциевую, магниевую и натриевую. Каждая группа в свою очередь подразделяется на четыре типа вод, определяемых соотношением между содержанием ионов в процентах в пересчете на количество вещества эквивалента:
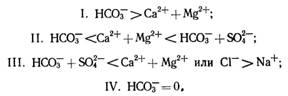
Воды типа I образуются в процессе химического выщелачивания изверженных пород или при обменных процессах ионов кальция и магния на ион натрия. Чаще всего они маломинерализованные, исключение составляют воды бессточных озер.
Воды типа II смешанные. Их состав может быть связан генетически как с осадочными породами, так и с продуктами выветривания изверженных пород. К этому типу относится вода большинства рек, озер и подземные воды с малой и умеренной минерализацией.
Воды типа III метаморфизованные. Они включают какую-то часть сильно минерализованных природных вод или вод, подвергшихся катонному обмену ионов натрия на ионы кальция и магния. К этому типу относится вода океанов, морей, лиманов (морских), реликтовых водоемов и др.
К типу IV, характеризуемому отсутствием НСОз-, относятся кислые воды — болотные, шахтные, вулканические или воды, сильно загрязненные промышленными сточными водами. Воды типа IV принадлежат только к сульфатному и хлоридному классам, где не может быть вод типа I.
Возможность существования природных вод других классов (нитратный, боратный) не исключена, но крайне маловероятна. Более реально преобладание в некоторых водах кремниевой кислоты, но она почти целиком недиссоциирована и не уравновешивает катионов.
Выделение в отдельный класс природных вод с преобладанием органического вещества невозможно, т. к. органическое вещество природных вод обладает весьма сложным составом.
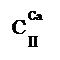 Для краткого обозначения 27 видов природных вод применены символы. Класс обозначен символом, выведенным из названия соответствующего аниона (С, S, C1), а группа — своим химическим символом, который проставляется в виде степени к символу класса. Принадлежность к типу обозначает римская цифра в индексе к символу класса. Следовательно, символы пишутся следующим образом:
Для краткого обозначения 27 видов природных вод применены символы. Класс обозначен символом, выведенным из названия соответствующего аниона (С, S, C1), а группа — своим химическим символом, который проставляется в виде степени к символу класса. Принадлежность к типу обозначает римская цифра в индексе к символу класса. Следовательно, символы пишутся следующим образом:
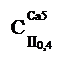 (гидрокарбонатный класс, группа кальция, тип II). Кроме того, для количественной характеристики добавляется минерализация воды (внизу, с точностью до 0,1%о) и общей жесткости в пересчете на молярную концентрацию вещества эквивалентов (вверху, с точностью до целых миллимолей в 1 дм3); например,
(гидрокарбонатный класс, группа кальция, тип II). Кроме того, для количественной характеристики добавляется минерализация воды (внизу, с точностью до 0,1%о) и общей жесткости в пересчете на молярную концентрацию вещества эквивалентов (вверху, с точностью до целых миллимолей в 1 дм3); например,
означает, что вода гидрокарбонатного класса, группы кальция, типа II, с минерализацией 0,4 г/дм3 и жесткостью 5 ммоль/дм3.