Урок №49. Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охарактеризуйте этот процесс при помощи электронного баланса.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе?
№2. Закончите уравнения химических реакций, разберите с т.зрения ОВР
Al + H2SO4 (раствор) ->
Al + CuCl2 ->
Al + HNO3(конц) -t->
Al + NaOH + H2O ->
№3. Осуществите превращения:
Al -> AlCl3 -> Al -> Al2S3 -> Al(OH)3 -t->Al2O3 -> Al
№4. Решите задачу:
На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л газа (н.у.). Вычислите процентный состав сплава, если его общая масса была 10 г?
Урок №50. Амфотерность оксида и гидроксида алюминия.
https://www.sites.google.com/site/himulacom/zvonok-na-urok/9-klass---vtoroj-god-obucenia/urok-no50-amfoternost-oksida-i-gidroksida-aluminia
Осуществите превращения:
1) Al -> Al(OH)3 -> AlCl3 - > Al(OH)3 > Na[Al(OH)4]
2) Al -> Al2O3 ->Na[Al(OH)4] -> Al(OH)3 -> Al2O3 - > Al
Дополнительные ресурсы для изучения темы
https://chemege.ru/aluminium/
https://foxford.ru/wiki/himiya/stroenie-i-svoystva-alyuminiya-i-ego-soedineniy
Строение и свойства алюминия и его соединений
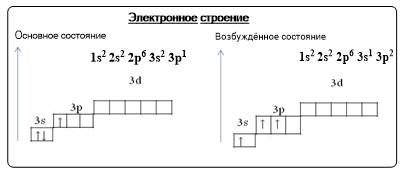
Алюминий - элемент III группы, главной «А» подгруппы, 3 периода периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
В возбужденном состоянии на внешнем уровне алюминия находится три неспаренных электрона. Поэтому в соединениях с ковалентной связью алюминий проявляет валентность III. Во всех соединениях алюминий проявляет постоянную степень окисления: +3.
Физические свойства

Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 ∘C. Алюминий имеет невысокую плотность (2,7 г/см3) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл
Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. В природе алюминий встречается только в соединениях (минералах):
- Бокситы — Al2O3⋅H2O (с примесями SiO2,Fe2O3,CaCO3)
- Нефелины —KNa3[AlSiO4]4
- Алуниты — KAl(SO4)2⋅2Al(OH)3
- Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
- Корунд — Al2O3
- Полевой шпат (ортоклаз) — K2O⋅Al2O3⋅6SiO2
- Каолинит — Al2O3⋅2SiO2⋅2H2O
- Алунит —(Na,K)2SO4⋅Al2(SO4)3⋅4Al(OH)3
- Берилл — 3BeO⋅Al2O3⋅6SiO2



Берилл Корунд Нефелин
Химические свойства
Алюминий – химически активный металл, но прочная оксидная пленка состава Al2O3 определяет его стойкость при обычных условиях. Практически во всех химических реакциях алюминий проявляет восстановительные свойства.
Взаимодействие с неметаллами
С кислородом взаимодействует только в мелкораздробленном состоянии при высокой температуре:
4Al+3O2=2Al2O3
реакция сопровождается большим выделением тепла (1676 кДж).
С галогенами (кроме фтора) алюминий реагирует при комнатной температуре, с образованием галогенидов:
2Al+3Cl2=2AlCl3
С водородом непосредственно не взаимодействует.
С другими неметаллами алюминий реагирует при нагревании, образуя бинарные соединения:
2Al+3F2=2AlF3 фторид алюминия (t=600∘C)
2Al+3S=Al2S3 сульфида алюминия (t=200∘C)
Al+P=AlP фосфид алюминия (t=500∘C)
2Al+N2=2AlN нитрид алюминия (t=800∘C)
4Al+3C=Al4C3 карбид алюминия (t=2000∘C)
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и летучих водородных соединений (сероводорода, фосфина, аммиака, метана и т.д.):
Al2S3+6H2O=2Al(OH)3↓+3H2S↑
Al4C3+12H2O=4Al(OH)3↓+3CH4↑
2. С металлами образует сплавы, которые содержат интерметаллические соединения – алюминиды, например, CuAl2, CrAl7, FeAl3 и др.
3. Очищенный от оксидной пленки алюминий энергично взаимодействует с водой:
2Al+6H2O=2Al(OH)3↓+3H2↑
В результате реакции образуется малорастворимый гидроксид алюминия и выделяется водород.
4. С оксидами менее активных металлов:
Cr2O3+2Al=Al2O3+2Cr
Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
5. Алюминийлегко взаимодействует с разбавленными кислотами, образуя соли:
2Al+6HCl=2AlCl3+3H2↑
разб.2Al+3H2SO4разб.=Al2(SO4)3+3H2↑
Al+4HNO3=Al(NO3)3+NO↑+2H2O
в качестве продукта восстановления азотной кислоты также может быть азот и нитрат аммония.
Запомнить! С концентрированной азотной и серной кислотами при комнатной температуре алюминий не взаимодействует (пассивация); при нагревании реагирует с образованием соли и продукта восстановления кислоты:
(конц.)2Al+6H2SO4(конц.)→t,∘CAl2(SO4)3+3SO2↑_+6H2O
(конц.)Al+6HNO3(конц.)→t,∘CAl(NO3)3+3NO2↑_+3H2O
6. Алюминий – амфотерный металл, он легко реагирует со щелочами:
- в растворе с образованием тетрагидроксоаалюмината натрия:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
· при сплавлении с образованием алюминатов:
2Al+6KOH=2KAlO2+2K2O+3H2↑
7. С солями менее активных металлов (стоящих в ряду напряжения правее алюминия):
2Al+3NiSO4=3Ni+Al2(SO4)3
Соединения алюминия
 Оксид алюминия Al2O3
Оксид алюминия Al2O3
твердое вещество белого цвета, тугоплавкое. Не реагирует с водой и не растворяется в ней. Типичный амфотерный оксид, поэтому реагирует и с кислотами и со щелочами.
При взаимодействии с кислотами образуется соль и вода:
Al2O3+6HCl=2AlCl3+3H2O
Со щелочами алюминий реагирует в расплаве и в растворе:
Запомнить!
- при сплавлении образуется метаалюминат натрия:
Al2O3(тв)+2NaOH (тв) →t,∘C 2NaAlO2+H2O
- в растворе щёлочи образуется тетрагидроксоалюминат натрия:
Al2O3+2NaOH+3H2O=2Na[Al(OH)4]