Из курса неорганической химии 9 класса известны некоторые сведения о химических свойствах металлов. Главная задача изучении тайного вопроса на уроке — обобщить основные сведения теории о химической активности металлов на основании строения их томов. В атомах металлов на внешнем энергетическом уровне малое количество электронов и очень большой атомный радиус, что способствует быстрой отдаче электронов атомами металлов в результате их взаимодействия с другими соединениями.
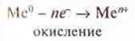
Металлы окисляются, сами выступают восстановителями. Химическую активность металлов можно оценить на основании их Положения в ПСХЭ.
В периодах — с увеличением заряда ядра атома она ослабевает; в группах, главных подгруппах с возрастанием заряда ядра она усиливается, т. к. чем больше атомный радиус и меньше электронов на внешнем энергетическом уровне, тем меньше требуется энергии на их отрыв.
Однако чаше реакции протекают в водных растворах. Химическая активность металлов тогда будет определяться на основании их положения в электрохимическом ряду напряжений металлов. В этом ряду металлы расположены с учетом затрат энергии на игры» валентных электронов и разрушение кристаллической решетки, а также с учетом энергии, выделяющейся при гидратации иона металла.
Таким образом, чем меньше энергии затратится на отрыв и разрыв кристаллической решетки и выделится больше энергии при гидратации ионов металлов, тем сильнее восстановительная способность металла в реакциях, происходящих в водных растворах, тем левее он располагается в ряду напряжений металлов.
Следует отметить следующее: высокая электрохимическая активность металла не всегда означает его химическую активность (и наоборот). Обратите внимание на расположение Li и Na в ПСХЭ и в электрохимическом ряду напряжений металлов.
На основании их расположения в ПСХЭ Na активнее Li (учитывается только один фактор — атомный радиус Ar(Na) > Ar(Li)). На основании положения в электрохимическом ряду напряжений металлов Li стоит левее Na, его восстановительная способность выше, т. к. в этом случае учитывается не только атомный радиус металлов, но и энергия отрыва электронов, энергия разрушения кристалла и энергия гидратации ионов металлов. В целом три фактора.
Работая с электрохимическим рядом напряжений металлов, следует помнить:
— металлы расположены в порядке убывания восстановительных свойств при реакциях в растворах (t° = 25 °С, Р = 1 атм);
— металл, стоящий левее, вытесняет правее стоящий металл из растворов их солей;
— металл, стоящий в ряду напряжений до водорода, вытесняет его из разбавленных кислот (кроме HNO3(разб.), HNО3(конц.) и H2SО4(конц.));
— металлы, стоящие в ряду напряжений до Al, взаимодействуют с водой с образованием щелочей и выделением водорода. Остальные металлы взаимодействуют в жестких условиях с образованием оксида металла и водорода;
— металлы, стоящие в ряду напряжений за водородом, не взаимодействуют с водой;
— на основании восстановительной способности металлов в ряду напряжений металлы условно можно разделить на три группы по активности:
от Li до Аl — очень активные металлы;
от Аl до Н2 — металлы средней активности;
от Н2 до Au — малоактивные металлы.
Зная такое условное деление металлов по их химической активности, возможно правильное объяснение их химических свойств по отношению к простым и сложным веществам.
1. Взаимодействие металлов с простыми веществами — неметаллами и металлами:
а) взаимодействие с кислородом:


Образуются пероксиды и оксиды.
б) взаимодействие с серой.
Эксперимент:
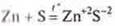 — сульфид цинка
— сульфид цинка
Образуются сульфиды.
в) взаимодействие с галогенами:
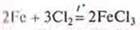
Mg + Cl2 = MgCl2 без нагревания.
Галогениды: фториды, хлориды, бромиды, иодиды.
г) взаимодействие с водородом — только активные металлы:
2Na + Н2 = 2NaOH — гидрид натрия;
д) взаимодействие с азотом:
6Li + N2 = 2Li3N — без нагревания.
Остальные металлы реагируют с азотом при нагревании; обратился нитриды.
е) взаимодействие с металлом, получение интерметаллического соединения: Cu3Au, LaNi5.
2. Взаимодействие со сложными веществами:
а) взаимодействие с водой.
Эксперимент:
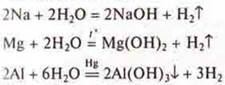 — удаление оксидной пленки под слоем ртути,
— удаление оксидной пленки под слоем ртути,
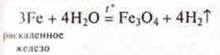
Чем активнее металл, тем скорость реакции выше.
б) взаимодействие металлов с растворами неорганических и органических кислот.
Эксперимент: взаимодействие металлов Mg, Zn, Fe, Сu с растворами:
а) соляной кислоты:
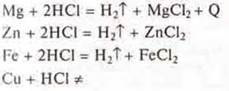
б) уксусной кислоты:
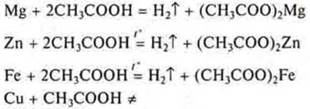
На основании положения металлов Mg, Zn, Fe в электрохимическом ряду напряжений металлов убеждаемся экспериментально в том, что они вытесняют водород из растворов кислот. Они расположены до водорода. Сu — не вытесняет водород из растворов кислот, т. к. расположен в электрохимическом ряду напряжений за водородом.