Энтропия системы
Критерием направления процессов в изолированных системах является изменение энтропии S. Понятие энтропии введено Клаузиусом (1865 г.).
Для обратимого процесса: 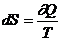 , для необратимого dS>
, для необратимого dS> 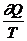 .
.
Поскольку в изолированной системе отсутствует теплообмен, т.е. dQ = 0, то
dS ³ 0. Т.е. любой необратимый (спонтанный) процесс характеризуется увеличением энтропии изолированной системы (dS > 0) и любой обратимый (равновесный) процесс характеризуется неизменностью энтропии изолированной системы (dS = 0).
Клаузиус: Энтропия всякой изолированной системы стремится к максимуму.
Энтропия характеризует степень хаотичности расположения молекул в веществе или тел в системе, т.е. S – мера неупорядоченности системы.
В системах, в которых не происходит никаких энергетических изменений (DH=0),
cамопроизвольно протекают процессы, идущие с увеличением энтропии, т.е.
ΔS = S2 – S1 > 0.
Энтропия – функция термодинамической вероятности W системы
S = k ln W,
где k = 1.38∙10-23 Дж/К - постоянная Больцмана.
Термодинамическая вероятность W определяется числом микросостояний, с помощью которых можно осуществить данное макросостояние системы.
Природа стремится от состояний менее вероятных к состояниям более вероятным.
Итак, в изолированной системе самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает.
Для конечного процесса (конкретного) ΔS ³ 0.
Энтропия – функция состояния системы, т.е. ее изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода.
В ходе химической реакции изменение энтропии DS х.р. вычисляется на основе закона Гесса:
DS0х.р. = (åDS0298)прод. - (åDS0298)исх. в-в.
Абсолютные значения энтропиииндивидуальных веществ при стандартных условиях S0298 вычислены и сведены в таблицы, так же как DH0f.
В соответствии с физическим смыслом энтропии, W возрастает при переходе от твердого состояния вещества в жидкое и газообразное. Так, значение энтропии SO3 в газообразном, жидком и твердом состояниях равны соответственно 243.3; 95.76 и 52.3 Дж/мольК. Энтропия зависит от строения вещества: чем сложнее частица, тем больше энтропия.
S (O) = 160.9; S (O2) = 204.8; S (O3) = 268.7 Дж/мольК.
Энтропия системы возрастает при нагревании и уменьшении давления.
Общие условия равновесия. Свободная энергия системы.
Система находится в равновесном состоянии, если все характеризующие ее признаки во всех участках системы будут неизменными сколь угодно долго.
Используя принцип максимальной энтропии при равновесии, американский ученый Гиббс (1874 г.) построил общую теорию термодинамического равновесия. Он ввел понятия термодинамических потенциалов: G и F.
G – изобарно-изотермический потенциал, функция Гиббса (энергия Гиббса) для процессов при р = const и Т = const.
F – изохорно-изотермический потенциал (энергия Гельмгольца) для процессов при V = const и Т = const.
Для конечных процессов:
G = H - T∙S DG = DH - T∙DS
F = U - T∙S DF = DU - T∙DS
Изменение энергии Гиббса при р = const и Т = const равно максимальной полезной работе, совершаемой системой или над системой, т.е. работе химических, электрических или других сил, за исключением работы расширения.
В этом – физический смысл функции Гиббса (свободной энергии).
С другой стороны,
DH = DG + T∙DS; DU = DF + T∙DS,
т.е. DG и DF – та часть внутренней энергии или энтальпии, которая может превратиться в полезную работу.
Другая часть энергии или энтальпии системы, равная T∙DS называется связанной энергией и в работу превратиться не может.
Для любой химической реакции DG можно рассчитать по уравнениям:
1) DG0 = DH0 - T∙DS0 уравнение Гиббса-Гельмгольца;
2) DG0х.р. = (åDG0)прод. - (åDG0)исх. в-в.
3) DG0f = DH0f - T∙DS0f, где DG0f – энергия Гиббса образования.
При р = const и Т = const химические реакции могут самопроизвольно протекать в направлении, при котором энергия Гиббса уменьшается (DG0 < 0).
DG0 < 0 – условие самопроизвольного протекания процесса.
При рассмотрении уравнения Гиббса-Гельмгольца можно отметить несколько вариантов ее изменения;
1) DH0 < 0; DS0 < 0. Тогда при некоторой Т (верхняя предельная температура)
DG0 = 0.
2) DH0 > 0; DS0 > 0 - при некоторой Т (нижняя предельная температура)
DG0 = 0.
3) DH0 < 0; DS0 > 0. Процесс всюду термодинамически разрешен, т.к. DG0 < 0
всегда.
4) DH0 > 0; DS0 < 0. В этом случае DG0 всюду положительна. Процесс
термодинамически запрещен при рассматриваемых физико-химических условиях его проведения (Т, р, среда).