Волновая функция
Фотка
11) Уравнение Шредингера — линейное дифференциальное уравнение в частных производных, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах. + Фотка
12)Задание квантовых чисел полностью характеризует состояние частицы.
Некоторые квантовые числа связаны с движением в пространстве и характеризуют вид волновой функции частицы. Это, например, главное ({\displaystyle n_{r}}), орбитальное ({\displaystyle l}), магнитное ({\displaystyle m}) и спиновое квантовые числа электрона в атоме
13) Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле.
15) Внутренняя энергия тела (обозначается как E или U) — полная энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Следовательно, внутренняя энергия складывается из кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между ними и внутримолекулярной энергии.
Внутренняя энергия тела - энергия движения и взаимодействия частиц, из которых состоит тело.
16)
Энтальпи́я, также тепловая функция и теплосодержание —термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
H= U+pV
17)
Стандартные условия для температуры и давления — это значения температуры и давления, с которыми соотносятся значения других физических величин, зависящих от давления и температуры
Стандартные условия (англ. Standard Ambient Temperature and Pressure, SATP):
· давление 1 Бар = 105 Па = 750,06 мм рт. ст.;
· температура 298,15 К = 25 °С.
18) Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моль вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 74.9 кДж/моль.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
Δ H реакцииO = ΣΔ H fO (продукты) — ΣΔ H fO (реагенты)
19)
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это потенциал следующего вида:
G=U+PV- TS
{\displaystyle \,\!G=U+PV-TS}
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
20) Фотка
21) Порядок реакции по данному веществу, показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Согласно действующих масс закону, скорость у простой (одностадийной) реакции между веществами А и В типа nАА + nBB: продукты равна:
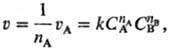
где uА-скорость расходования реагента А, СА и Св-концентрации реагентов А и В, k - константа скорости р-ции, nА и nв-порядки реакции по реагентам А и В соотв., п = nА + nв-общий порядок реакции (nА и nв- частные порядки реакции). Для гомог. р-ции порядок реакции по данному в-ву представляет собой стехиометрич. коэф. этого в-ва в ур-нии р-ции. Напр., в р-ции 2NO + С12: 2NOC1 порядок реакции по NO равен 2, порядок реакции по С12 равен 1, а общий порядок реакции равен 3. Для простых р-ций порядок реакции всегда целое число (1, 2 или 3).
22) Фотка
23)
Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества.
24)
Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
А2 + В2 ⇄ 2AB
25)
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.
Анри Ле Шателье (Франция) сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый Карлом Брауном.
Влияние температуры
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому.
N2 + 3H2 ⇄ 2NH3 + Q
Прямая реакция — экзотермическая, а обратная реакция — эндотермическая.
Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Влияние давления
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам: При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом:
N2 + 3H2 ↔ 2NH3
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400°С:
давление, МПа 0,110203060100
объемная доля NH3, %0,42636466680
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
26)
29)
В химической практике применяются растворы с различным содержанием растворенного вещества. Для таких растворов используют следующие способы выражения концентрации растворенного вещества: массовая доля и мольная доля растворенного вещества, молярная и моляльная концентрации, молярная концентрация эквивалента.
Для представления расчетных формул в настоящем практикуме введены следующие обозначения: раствор (y) = растворенное вещество (x) + растворитель (z), тогда,
-параметры растворенного вещества - m(x) масса, M(x) молярная масса, э(х) эквивалент, nм(х)- число молей, nэ(х) – число эквивалентов;
-параметры раствора - m(y)– масса, V(y) - объем, (y) - плотность;
-параметры растворителя - m(z) - масса, V(z) - объем, nм(z) - число молей, r(z)- плотность.
30)
2.1 Массовая доля (С%)
или процентная концентрация определяет, какую частьмасса растворенного вещества составляет от массы раствора (обычно в процентах), и рассчитывается как отношение:
С% = m(х) •100% или С% = m(х) •100%
m(у)) m(х)+m(z)
31) Объемная доля – так же как и массовая доля, только вместо массы объёмы!
32)
2.5 Мольная доля (Сm)
показывает, какую часть число молей растворенного вещества составляет от суммы числа молей растворенного вещества и растворителя в растворе. Для двухкомпонентного раствора, состоящего из растворителя и одного растворенного вещества мольная доля рассчитывается по уравнению:
n(х) m(x)/M(х)
Сm = —————— = ———————————,
n(х) + n(z) m(х)/M(x) + m(z)/M(z)
33)
2.2 Молярная концентрация (См)
или молярность определяет, сколько молей растворенного вещества содержится в каждом литре данного раствора, и рассчитывается как отношение количества растворенного вещества в молях nм(х), содержащегося в растворе, к объему этого раствора:
nм(х) моль m(х) m(х) • ρ(у)
СМ = ————— = ————— = ————————
V(y) л М(х) V(y) М(х)•[(m(z)+m(х)]
34)
2.3 Моляльная концентрация (Cm)
или моляльность определяет, сколько молей растворенного вещества приходятся на каждый килограмм растворителя, и рассчитывается как отношение количества растворенного вещества в молях n(х) к массе растворителя:
nм(х) моль m(х) m(х)
Сm ————— = ———— = ———————
m(z) кг М(х) m (z) М(х)•[m(y)-m(х)]
35)
4 Молярная концентрация эквивалента ( СN)
или нормальность определяет, сколько молей эквивалента растворенного вещества содержится в каждом литре раствора, и рассчитывается как отношение количества растворенного вещества в молях эквивалента nэ(х), содержащегося в растворе, к объему этого раствора:
nэ(х) моль m(х) СМ
СN = ————— = ——————— = ————
V(у) л Э(х) М(х) • V (y) Э(х)
36)
Титр раствора — способ выражения концентрации, применяемый, в основном, в аналитической химии. Обозначается заглавной латинской буквой T (тэ). Измеряется в г/мл (г/см³).
Различают титр по растворённому веществу и титр по определяемому веществу (условный титр).
Титр по растворённому веществу или просто титр — масса растворённого вещества (в граммах), содержащаяся в одном миллилитре (см³) раствора.
Рассчитывается по формуле:
T=m/V{\displaystyle T={\frac {m}{V}}},
где
T{\displaystyle T} — титр раствора (в г/мл);
{\displaystyle m} m— масса растворённого вещества (в г);
{\displaystyle V} V— объём раствора (в мл).
37)
Средняя молекулярная масса смеси газов
Перемножить процентное содержание газов на их молек. массы и поделить на 2!
2. Вычислите среднюю молекулярную массу смеси газов, состоящей из 80% метана и 20% кислорода (по объему).
Ответ: ((0,8M(CH4)+0.2M(O2))\2=9.6
38)
Кол-во теплоты, поглощающееся или выделяющееся при растворении одной молекулы в-ва называется теплотой растворения этого в-ва.
Теплота растворения имеет отриц. значение, если при растворении теплота поглощается, и положительное – при выделении теплоты. Выражается в ккал/моль!
39)
Осмос — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества.
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
41)
Неэлектролиты - это вещества, растворы или расплавы которых не проводят электрический ток. К ним относятся: кислород, водород, многие органические вещества (сахара, эфиры, бензол и др.). В молекулах этих веществ существуют ковалентные не полярные или малополярные связи.
42)
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
H2SO4 > 2H+ + SO42-
43)
Степень диссоциации равна отношению продиссоциированных молекул вещества к общему числу его молекул. Выражается в долях или процентах.
{\displaystyle \alpha ={\frac {n}{N}}\cdot 100\%}
Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Пример. Для уксусной кислоты CH3COOH величина равна 4% (в 0.1 М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, то есть находятся в виде ионов Н+ и СН3СОО−, остальные же 96 молекул не диссоциированы.
44)
Активность компонентов раствора — эффективная концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Отношение активности (a{\displaystyle ~a}) к общей концентрации вещества в растворе называется коэффициентом активности:
y= a/c
{\displaystyle \gamma ={a \over c}}
Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального. Отклонения от идеальности могут быть обусловлены различными химическими и физическими причинами — дипольные взаимодействия, поляризация, образование водородных связей, ассоциация, диссоциация, сольватация и др.
45)
Водородный показатель, pH — мера активности ионов водорода в растворе, количественно выражающая его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, выраженной в молях на один литр:
{\displaystyle {\mbox{pH}}=-\lg \left[{\mbox{H}}^{+}\right]\!} pH = -lg [ H+]
47)
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр);
α = (c гидр/ c общ)·100 %
где c гидр — число молей гидролизованной соли, c общ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
48)
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродного потенциала обусловлено пространств. разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя.
49)
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы — (ионы металлов,водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
50-51)
В зависимости от химических свойств различают:
· Солеобразующие оксиды:
· основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
· кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
· амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
· Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO.
52)
\
В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают:
· основные гидроксиды (основания) — только гидроксиды металлов со степенью окисления +1, +2, проявляющие основные свойства (например, гидроксид кальция Ca(ОН)2, гидроксид калия KOH, гидроксид натрия NaOH и др.) При реакциях и диссоциации отщепляется группа -OH.
· кислотные гидроксиды (кислородсодержащие кислоты) — гидроксиды неметаллов и металлов со степенью окисления +5, +6, проявляющие кислотные свойства (например, азотная кислота HNO3, серная кислота H2SO4,сернистая кислота H2SO3 и др.) При реакциях и диссоциации отщепляется протон.
· амфотерные гидроксиды, гидроксиды металлов со степенью окисления +3, +4 и нескольких металлов со степенью окисления +2, которые проявляют амфотерные свойства. Амфотерные гидроксиды проявляют в зависимости от условий либо основные, либо кислотные свойства (например, гидроксид алюминия Al(ОН)3, гидроксид цинкаZn(ОН)2).
Термин «гидроксиды» часто применяют только по отношению к основным и амфотерным гидроксидам. Также иногда называют гидроксидом воду.
53)