Теоретические сведения
Напряжением разложения индивидуальной соли Е называется то минимальное напряжение, которое должно быть приложено к электродам для того, чтобы вызвать устойчивое выделение продуктов электролиза. Пусть в условиях термодинамической обратимости (i → 0, Т и Р = const) протекает электрохимическая реакция разложения вещества АВ с образованием на катоде и аноде веществ А и В:
АВ → А + В.
Максимальная полезная работа в расчете на 1 моль вещества, которую необходимо совершить над системой для протекания данной реакции, определяется увеличением изобарно-изотермического потенциала (энергии Гиббса) и является работой, совершенной за счет электрической энергии:
Amax = -AG = nEF,
где п - количество электронов, принимающих участие в электрохимической реакции; F - число Фарадея (F = 96 487 А∙с); Е - электродвижущая
сила элементов.
Для того чтобы провести реакцию с конечной скоростью в прямом направлении, необходимо приложить извне напряжение, большее чем равновесная ЭДС (величина разности зависит от скорости процесса). Если процесс проводить с бесконечно малой скоростью (→ 0), то потенциал восстановления будет всего лишь на бесконечно малую величину отрицательнее равновесного 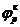 , а потенциал окисления - на бесконечно малую величину положительнее равновесного
, а потенциал окисления - на бесконечно малую величину положительнее равновесного 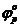 . Тогда напряжение разложения определится соотношением
. Тогда напряжение разложения определится соотношением
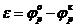
и практически численно будет равно равновесной ЭДС гальванического элемента, для цепи
А|АВ|В
может быть вычислено из изменения изобарно-изотермического потенциала соответствующей токообразующей химической реакции:
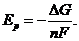
Таким образом, ЭДС разложения индивидуальных солей может быть рассчитана с использованием термодинамических данных, т.к.
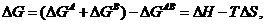
где ΔН - изменение энтальпии реакции; ΔS - изменение энтропии. Следовательно:
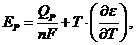
где QР - тепловой эффект химической реакции; 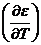 - температурный коэффициент ЭДС, равный
- температурный коэффициент ЭДС, равный 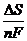 .
.
В свою очередь изменение энтальпии можно рассчитать по формуле
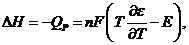
а изменение энтропии - по формуле
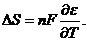
В реально работающей электрохимической системе напряжение на ячейке UB всегда больше напряжения разложения ЕР на величины суммарного катодного ηк и анодного ηа перенапряжений, омического падения напряжения в электролите IRэл, электродах и токоподводах IRT, контактах IRK, величин диффузионных скачков потенциала в электролите Δφдиф и термоЭДС Δφт.ЭДС в измеряемой цепи:
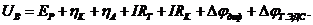
Напряжение разложения расплавленной соли может быть найдено различными экспериментальными путями:
измерением равновесной ЭДС химической цепи, составленной из соответствующих веществ, например: Pb | PbCl2| С12. Этот метод наиболее точен, но непременным условием его применения для получения точных результатов является полная обратимость цепи. Основной трудностью использования этого метода является создание обратимо работающего газового электрода;
снятием кривой напряжения - ток (см. ниже);
измерением обратной ЭДС.
Кроме того, напряжение разложения для индивидуальных солей может быть рассчитано с использованием термодинамических данных, как это было показано выше.
При определении величины напряжения разложения по данным снятой U-I кривой необходимо, либо точно учесть значения остальных членов уравнения, либо подобрать такие условия, чтобы они были равны нулю.
Величины перенапряжений как катодного, так и анодного процессов определяют степень необратимости электрохимической реакции, являются функцией плотности тока и в общем случае слагаются из перенапряжения диффузии, перенапряжения перехода и перенапряжения реакции:
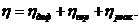
Перенапряжение диффузии возникает при электролизе разбавленных солей и обуславливается тем, что при включении тока приэлектродный слой начинает обедняться потенциалопределяющими ионами, т.к. их скорость разряда в начальный момент времени превышает скорость их доставки из глубины расплава за счет диффузии. Вследствие этого в приэлектродном слое возникает градиент концентрации по потенциалопределяющим ионам, что увеличивает их скорость доставки к поверхности электрода (1-й закон Фика). Конечная величина градиента концентрации будет определяться равенством скоростей доставки и разряда. Таким образом, в стационарном состоянии у поверхности электрода будет находиться более разбавленный электролит по сравнению с исходным состоянием, поэтому для осуществления электрохимического процесса в данных условиях приходится прикладывать на ячейку большее напряжение (по уравнению Нернста), чем равновесная ЭДС, на некоторую величину ηдиф, называемую концентрационным перенапряжением.
Необходимо отметить, что для анодного процесса лимитирующей стадией электрохимического процесса, помимо доставки потенциалопределяющих ионов к поверхности электрода, может быть процесс диффузии (отвода) прореагировавших частиц от электрода вглубь расплава (например диффузия молекулярного хлора). Вследствие этого прианодный слой будет обогащаться продуктами электродной реакции, создавая затруднения для протекания электродного процесса. Перенапряжение диффузии стремится к нулю при I → 0, а также в расплавах индивидуальных солей. Перенапряжение перехода обусловлено трудностью переноса заряда через границу электрод-электролит. При I → 0 ηдиф → 0.
В расплавах переход заряженных частиц через границу электрод-электролит происходит без заметных торможений, поэтому ппер близко к нулю даже при значительных плотностях тока. Большинство электродных процессов включает в себя, как необходимую составную часть, чисто химическое превращение (например образование молекулы хлора из его атомов), которое может или предшествовать электрохимическому акту или следовать за ним, и оно заметно влияет на кинетику электрохимического процесса. Если скорость электродного процесса определяется скоростью протекания химической реакции, то в этом случае возникает так называемое перенапряжение реакции. Омическое падение напряжения в электролите и во внешней цепи
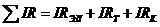
определяется силой тока, зависит от сопротивления электролита Rэл, природы и размеров токоподводов RT, удельного давления на контактах и стремится к нулю при I → 0.
Величина термоЭДС в измеряемой цепи зависит от материала электролита и токоподводов и для расплавов в интервале температур 300 - 1000 °С находится в пределах 1 - 10 мВ.
Величина Δφдиф определяет сумму скачков потенциалов на возможных границах раздела в электролите между катодным и анодным пространством при наличии неоднородности их состава и для индивидуальных солей равна нулю.
Если Δφдиф = 0 и учтена поправка на термоЭДС, то при небольших силах тока 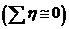 с некоторыми допущениями получим:
с некоторыми допущениями получим:
U = Ep+IRЭЛ.
Рассмотрим процессы, протекающие на двух одинаковых индифферентных электродах, погруженных в расплавленную печь при наложении поляризующего тока.
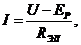
значит, электрический ток может протекать через ячейку только при U > ЕР. Однако на практике при U<EР через ячейку проходит весьма малый ток, но возрастающий по мере повышения напряжения (рис. 1). При достижении величины напряжения разложения происходит резкое возрастание силы тока. На графике этому соответствует перегиб в точке в, который делит кривую на два участка - ав и вс. Ток, протекающий через участок ав, называют остаточным. Он обусловлен дополнительным заряжением емкости двойного слоя, связанным с прохождением тока, а также протеканием побочных электрохимических процессов: разложением примесей, имеющих меньшее напряжение разложения по сравнению с основной солью, восстановлением иона Меn+ не до металла, а до субиона Mem+ (n > т) и другими процессами.
Участок ее соответствует протеканию устойчивого электролиза, и наклон кривой на этом участке определяется величиной омического падения напряжения в электролите, а также частично возрастанием диффузионного перенапряжения в случае электролиза разбавленных расплавов. Экстраполируя участок ве до пересечения с осью абсцисс (точка d), получим искомую величину напряжения разложения данной соли.
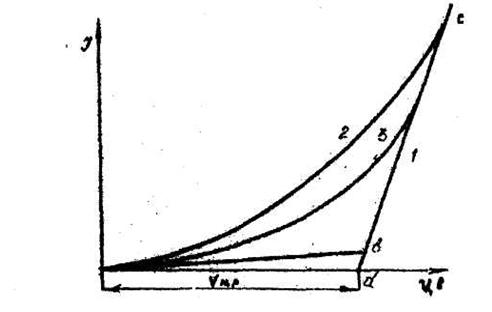
Рисунок 1. Теоретическая (1) и практические (2,3) кривые (2 – прямой ход, 3 – обратный)
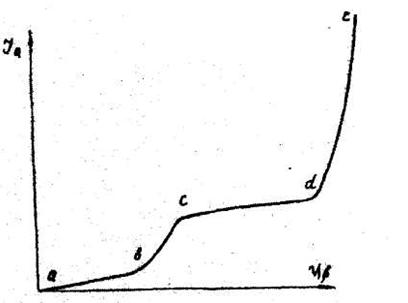
Рисунок 2. U – I кривая для расплава, содержащего два вида катионов.
Для расплавленных солей U-I кривые зачастую не имеют четкого перегиба. Это обусловлено тем, что высокие температуры (500-1000 °С) значительно снижают диффузионные ограничения при протекании электрохимических реакций, увеличивают скорость растворения продуктов реакции, в результате чего возможно протекание значительных остаточных токов (рис. 1). Более четкие U-I кривые получаются после продолжительного электролиза при снятии кривой обратного хода вследствие того, что на электродах образуется достаточное количество продуктов электролиза.
Процессы в ячейке при наличии в смеси расплавленных солей двух катионов не отличаются от ранее рассмотренных (рис. 2). При этом на участке вс разряжается более электроположительный катион, а на участке dc — более электроотрицательный.
Наиболее простым, но и наименее точным методом определения напряжения разложения является измерение обратной ЭДС при электролизе путем выключения тока. Она возникает вследствие работы образующегося гальванического элемента за счет окисления и восстановления продуктов электролиза на электродах. Поскольку величина обратной ЭДС обуславливается активностью ионов в приэлектродных слоях и активностью индивидуальных веществ на электродах, то в общем случае ее величина зависит от плотности тока (т.к. I определяет концентрацию ионов в приэлектродных слоях). Этот способ применяется в том случае, когда потенциал электродов сохраняет достаточно длительное время свое обратимое состояние.
Цель работы: определить напряжение разложения экспериментальным путем.
Порядок выполнения работы
Для определения напряжений разложения расплавленных солей используем установку, изображенную на рис. 3. В шахту электрической печи сопротивления 1 вставляется кварцевый стакан 2. Питание печи осуществляется от автотрансформатора, а температура в ячейке измеряется при помощи хромель-алюмелевой термопары 4 и милливольтметра 5.
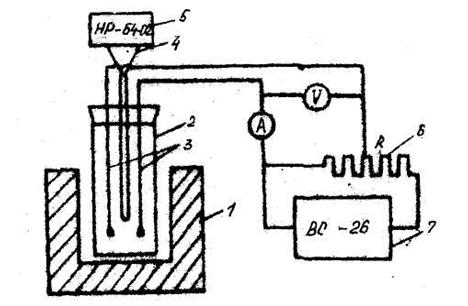
Рисунок 3. Принципиальная схема установки для измерения напряжения: 1 – печь сопротивления; 2 – ячейка; 3 – электроды; 4 – термопара; 5 – милливольтметр; 6 – реостат; 7 – источник питания.
Анодом и катодом 3 служат графитовые стрежни, которые закреплены в пробке реторты. Питание ячейки осуществляют от выпрямителя ВС-26 7, а регулирование напряжения в цепи - потенциометрическим включением реостата. Напряжение в цепи измеряют вольтметром 7-59, а ток - амперметром М-104.
В начале опыта рассчитали состав навески, произвели шихтовку заданной смеси солей, тщательно перемешали и засыпали в ячейку. Собирали электрическую схему установки и после расплавления электролита помещают в реторту предварительно прогретые в муфельной печи электроды. При достижении заданной температуры выполнили следующие действия:
включили поляризующую цепь постоянного тока;
установили напряжение на ячейке 2 В и затем постепенно повышали через 0,1 В. Для каждого стационарного напряжения измеряли силу тока.
Заносим полученные данные в таблицы
Таблица 1. Прямая
| U, В | |||||||||||||||||
| I, A | 0,045 | 0,075 | 0,075 | 0,077 | 0,09 | 0,11 | 0,175 | 0,26 | 0,325 | 0,41 | 0,51 | 0,72 | 0,915 | 1,125 | 1,3 | 1,46 |
Таблица 2. Обратная
| U, В | ||||||||||||||||
| I, A | 1,32 | 1,05 | 0,845 | 0,63 | 0,39 | 0,18 | 0,1 | 0,06 | 0,04 |
Строим графики зависимости I = f (U)
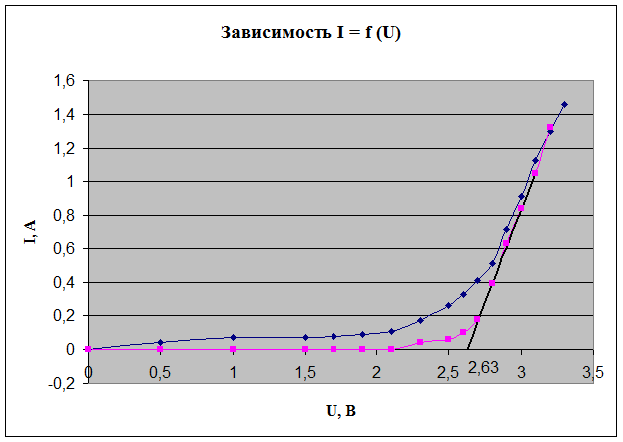
По обратной зависимости определяем напряжение разложение соли, которое составляет 2.63 В.
Вывод: в результате проделанной работы установили напряжение разложения расплавленной соли, которое составило 2.63 В. При определении напряжения разложения использовался способ измерения обратной ЭДС при электролизе путем выключения тока.