Адиабатический процесс – это процесс, который происходит без обмена теплом с окружающей средой, т.е. 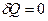 .
.
Экспериментально адиабатический процесс можно осуществить следующими способами:
1. Быстрый процесс, когда система не успевает обменяться теплом с окружающей средой.
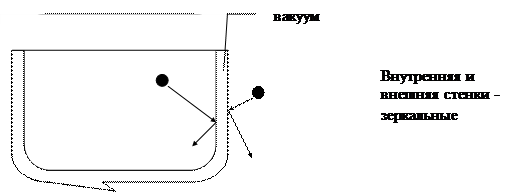 2. С использованием сосуда Дьюара (термоса):
2. С использованием сосуда Дьюара (термоса):
3. Тело поддерживает одинаковую температуру со стенками сосуда.

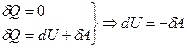
Т.е. изменение энергии происходит за счёт работы внешних сил.
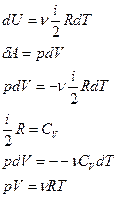
Берём полный дифференциал:
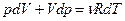 - здесь изменились ВСЕ параметры системы
- здесь изменились ВСЕ параметры системы
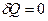
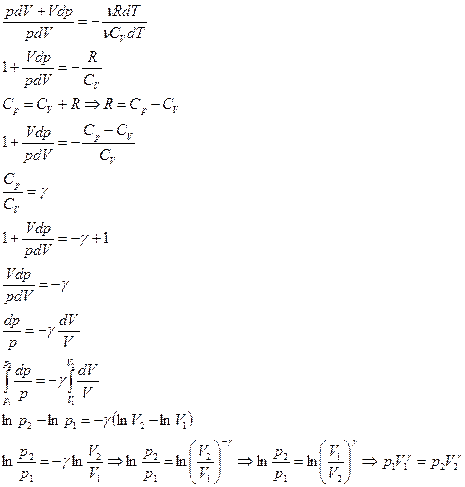
Т.к. состояния 1 и 2 выбраны произвольно, то получается, что
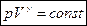 - уравнение адиабаты
- уравнение адиабаты
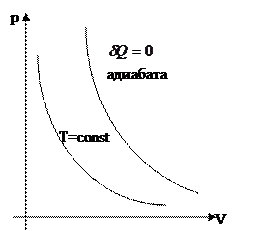
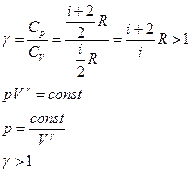
Для 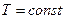
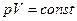
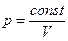
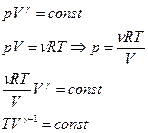
6. Работа, теплота и внутренняя энергия при изопроцессах и адиабатическом процессе.
Изохорный процесс (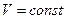 ).
).

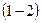 изохорное нагревание
изохорное нагревание
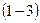 изохорное охлаждение
изохорное охлаждение
При изохорном процессе газ не совершает работы над внешними телами, т.е.:
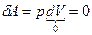
Из первого начала термодинамики (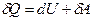 ) для изохорного процесса следует, что вся теплота, сообщаемая газу, идёт на увеличение его внутренней энергии:
) для изохорного процесса следует, что вся теплота, сообщаемая газу, идёт на увеличение его внутренней энергии: 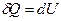 . Из формулы
. Из формулы 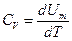 получаем, что
получаем, что 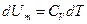 . Тогда для произвольной массы газа получим, что:
. Тогда для произвольной массы газа получим, что:
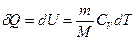 .
.
Изобарный процесс (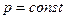 ).
).

Работа газа:
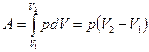 .
.
Если использовать уравнение Менделеева-Клапейрона для выбранных нами двух состояний, то: 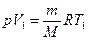 и
и 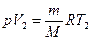 , откуда
, откуда 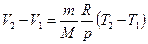 .
.
Тогда выражение для работы изобарного расширения примет вид:
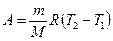
Из этого выражения вытекает физический смысл молярной газовой постоянной: если 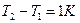 , то для 1 моля газа
, то для 1 моля газа 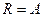 , т.е.
, т.е. 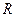 численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на
численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на 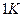 .
.
В изобарном процессе при сообщении газу массой  количества теплоты
количества теплоты
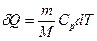
его внутренняя энергия возрастает на величину
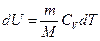 .
.
Изотермический процесс (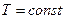 ).
).

Изотермический процесс описывается законом Бойля-Мариотта: 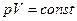 .
.
Диаграмма этого процесса в координатах 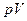 представляет собой гиперболу, расположенную тем выше, чем выше температура, при которой происходил процесс.
представляет собой гиперболу, расположенную тем выше, чем выше температура, при которой происходил процесс.
Исходя из выражения 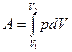 и уравнения Менделеева-Клапейрона (
и уравнения Менделеева-Клапейрона (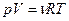 ), работа изотермического расширения газа:
), работа изотермического расширения газа:
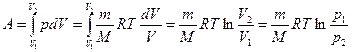 .
.
Т.к. при 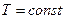 внутренняя энергия идеального газа не изменяется:
внутренняя энергия идеального газа не изменяется:
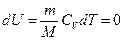 ,
,
то из первого начала термодинамики следует, что:
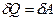 ,
,
т.е. всё количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
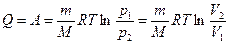 .
.
Следовательно, для того, чтобы при работе расширения температура не уменьшалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
Макро и микросостояния.
Описать систему можно полностью, задав положения и скорости всех атомов и молекул системы. Однако, это будет слишком подробным описанием, и вероятность такого состояния будет практически равна нулю.
Рассмотрим более грубое описание. Для этого разобьём весь объём на ячейки. Размер ячейки много меньше размера системы, но в каждую ячейку входит достаточно большое количество молекул.
Перенумеруем все молекулы. Будем считать положение данной молекулы (с данным номером) заданным, если будем знать её ячейку. При этом не важно местоположение в ячейке. Такое состояние называется микросостоянием.
С макроскопической токи зрения, все молекулы одинаковы. Поэтому, важно знать количество молекул в ячейке, но не конкретизировать номера молекул. Такое состояние называется макросостоянием.
Если молекулы перемещаются внутри ячейки, то не меняются ни микро, ни макросостояния.
Если одна молекула уходит, а другая приходит в ячейку, то микросостояние меняется, а макро – нет.
Таким образом, данное макросостояние может осуществляться неким числом способов (т.е. неким числом микросостояний). Число микросостояний, реализующих макросостояние, называется статистическимвесом или термодинамической вероятностью (обозначается 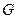 ).
).
Статвес принципиально отличается от обычной вероятности. Последняя всегда меньше единицы, а статвес больше либо равен единицы.
Возьмём некий объём и разобьём его на две половины – левую и правую. В объёме содержаться четыре молекулы (обозначим их цифрами от 1 до 4).
Тогда вероятность нахождения молекулы  в левой части равна
в левой части равна  .
.
Вероятность того, что молекулы 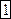 и
и 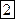 находятся в левой части равна
находятся в левой части равна 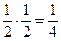 , т.к. событие, заключающееся в том, что обе молекулы принадлежат левой части – независимые события (т.е. вероятность одновременного нахождения слева равна произведению вероятностей).
, т.к. событие, заключающееся в том, что обе молекулы принадлежат левой части – независимые события (т.е. вероятность одновременного нахождения слева равна произведению вероятностей).
Вероятность нахождения в левом объёме всех четырёх молекул равна 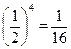 . Более того, вероятность любого расположения частиц во всём объёме, тоже равна
. Более того, вероятность любого расположения частиц во всём объёме, тоже равна 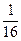 .
.
| макросостояние | микросостояние | статвес | вероятность | ||
| слева | справа | слева | справа | состояния | |
| - | 1,2,3,4 | - | 1/16 | ||
| 1,2,3 | 4/16 | ||||
| 1,2,4 | |||||
| 1,3,4 | |||||
| 2,3,4 | |||||
| 1,2 | 3,4 | 6/16 | |||
| 1,3 | 2,4 | ||||
| 1,4 | 2,3 | ||||
| 2,3 | 1,4 | ||||
| 2,4 | 1,3 | ||||
| 3,4 | 1,2 | ||||
| 2,3,4 | 4/16 | ||||
| 1,3,4 | |||||
| 1,2,4 | |||||
| 1,2,3 | |||||
| - | - | 1,2,3,4 | 1/16 |
Равновесноесостояние – это состояние, не имеющее тенденции к изменению, т.е. наиболее вероятное состояние. Из таблицы видно, что вероятность такого состояния прямо пропорциональна статвесу, т.е. в равновесном состоянии статвес максимален.
Рассмотрим неравновесный необратимый процесс, при этом все частицы находятся в левой части. Вероятность такого состояния минимальна.
В результате теплового движения частицы будут перемещаться вправо (перераспределяться по всему объёму). Это – необратимый процесс, т.к. вероятность того, что все частицы соберутся слева практически равна нулю. В результате перераспределения по всему объёму, система переходит из менее в более вероятные состояния. В равновесии статвес максимален и вероятность состояния тоже максимальна.
Энтропия.
Статвес определяет состояние системы, но не является единственной величиной. Покажем это: разделим объём на две части. Тогда 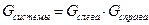 , т.е. статвес не является аддитивной величиной.
, т.е. статвес не является аддитивной величиной.
Но, можно взять 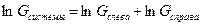 . Тогда энтропия (формула Больцмана):
. Тогда энтропия (формула Больцмана):
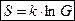
где 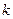 - постоянная Больцмана.
- постоянная Больцмана.
При максимальном статвесе, энтропия тоже максимальна. При необратимом процессе, система переходит из менее в более вероятное состояние, при этом увеличивается статвес, а значит и энтропия.
Находясь в равновесии, энтропия может кратковременно уменьшаться, но её можно считать постоянной в равновесии.
Закон возрастания энтропии (2-е начало термодинамики).
Энтропия в замкнутой изолированной системе (системе, предоставленной самой себе), может только возрастать или, достигнув своего максимального значения, оставаться постоянной.
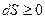 .
.
Статистической физикой доказано, что если системе сообщается некое количество теплоты 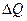 , то в ходе обратимого (обратимым является только изотермический процесс) процесса, энтропия:
, то в ходе обратимого (обратимым является только изотермический процесс) процесса, энтропия:
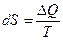 .
.
Энтропия является функцией состояния (зависит от параметров системы). Поэтому, для круговых процессов энтропия:
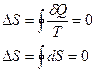 .
.
Состояние, которое осуществляется малым числом способов, называется упорядоченным; если большим числом, то беспорядочным. Поэтому, энтропия – это мера беспорядка в системе.
При сообщении системе кого-то количества теплоты, увеличивается мера беспорядка из-за теплового движения, т.е. увеличивается число микро и микросостояний, реализующих данное макросостояние, т.е. увеличивается статвес, а значит и энтропия.
Чес больше температура, тем больше внутренняя энергия системы, следовательно, тем меньше доля беспорядка, обусловленного сообщением системе количества теплоты 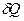 .
.
Возрастание энтропии в замкнутой системе соответствует увеличению хаотичности молекулярного движения, следовательно, система переходит в равновесное состояние, соответствующее полному беспорядку.
Вторая формулировка 2-го начала термодинамики:
При любых процессах, происходящих в изолированной системе, система переходит из менее в более вероятные состояния.
Если количество теплоты сообщается системе в ходе необратимого процесса, то возрастание энтропии обусловлено как сообщением количества теплоты, так и необратимостью процесса. Тогда
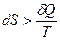 .
.
Для обратимого и необратимого процессов:
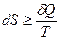 ,
,
где знак 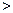 соответствует необратимому процессу, а знак равенства – обратимому.
соответствует необратимому процессу, а знак равенства – обратимому.
Поскольку энтропия – есть функция состояния, то её можно выразить через параметры состояния (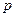 ,
, 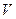 ,
, 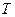 ).
).
Третье начало термодинамики:
При 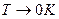 всего одно микросостояние реализует макросостояние (основное состояние), т.е.
всего одно микросостояние реализует макросостояние (основное состояние), т.е. 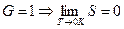 (теорема Нернста).
(теорема Нернста).
Выразим энтропию через параметры состояния:
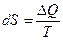 .
.
Из 1-го начала термодинамики:
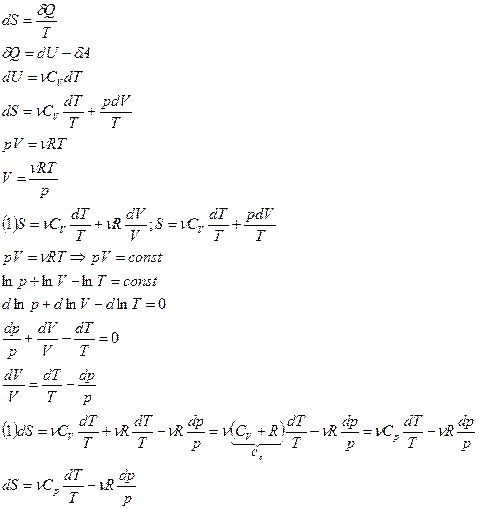 .
.
В физике часто используют 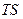 -диаграмму:
-диаграмму:
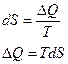 .
.

Изобразим в 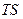 -координатах различные изопроцессы.
-координатах различные изопроцессы.
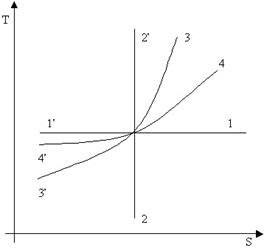
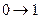
| 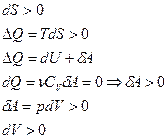 изотермическое расширение
изотермическое расширение
|
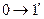
| 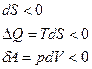 изотермическое сжатие
изотермическое сжатие
|
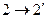
| 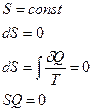 адиабатический процесс (изоэнтропийный)
адиабатический процесс (изоэнтропийный)
|
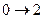
| 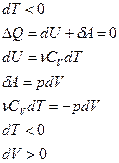 адиабатическое расширение
адиабатическое расширение
|
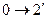
|  адиабатическое сжатие
адиабатическое сжатие
|
 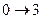
| 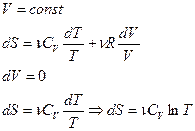
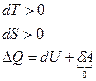 изохорное нагревание
изохорное нагревание
|
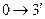
| 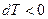 изохорное нагревание
изохорное нагревание
|
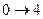
| 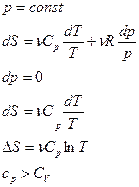
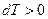 изобарное нагревание
изобарное нагревание
|
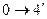
| 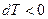 изобарное охлаждение
изобарное охлаждение
|
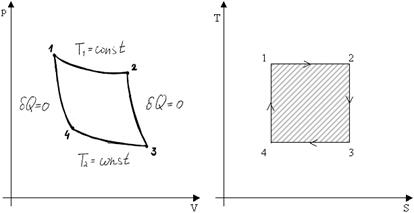
При циклическом процессе 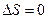 . Рассмотрим цикл Карно:
. Рассмотрим цикл Карно:
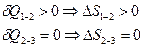
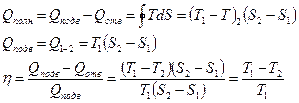 .
.
Круговые процессы.
Круговым процессом (циклом) называют процесс, при котором система, пройдя через ряд состояний, возвращается в исходное.
На диаграмме цикл изображается замкнутой кривой:
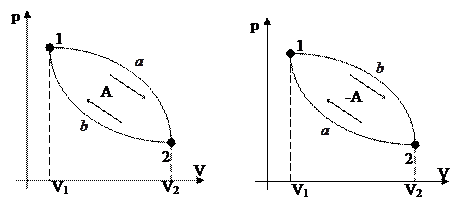 |
Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (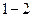 ) и сжатия (
) и сжатия (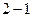 ) газа.
) газа.
Работа расширения (определяется площадью фигуры 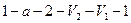 ) положительна (
) положительна (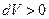 ), работа сжатия (фигура
), работа сжатия (фигура 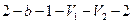 ) отрицательна. Следовательно, работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой.
) отрицательна. Следовательно, работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой.
Прямой цикл (совершается по часовой стрелке) используется в тепловых двигателях, обратный – в холодильных машинах.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю. Поэтому, первое начало термодинамики для кругового процесса выглядит так:
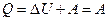
Однако, в результате кругового процесса система может теплоту как получать, так и отдавать, поэтому 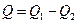 , где
, где 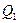 - количество теплоты, полученное системой, а
- количество теплоты, полученное системой, а 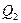 - отданное.
- отданное.
Тогда коэффициент полезного действия:
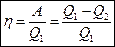
Процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причём если такой процесс проходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.