Кристаллическое строение вещества.
Физические свойства минералов определяются их кристаллическим строением. Минералы состоят из атомов химических элементов. Соединяясь друг с другом, атомы вносят в минерал присущие им качества. Однако в результате взаимодействия качества отдельных атомов проявляются у минерала в преобразованном виде. Минерал как целое получает свои, специфические качества, отличающиеся от качеств каждого из составляющих его атомов и не сводящиеся к простой сумме таковых(Григорьев, 1962).
Рассмотрим те особенности атомов, какие необходимо принимать во внимание при изучении природы минералов и при объяснении их качеств.
Строение атома.
Атом состоит из тяжелого атомного ядра и вращающихся вокруг него легких электронов, образующих «электронную атмосферу». В ядре находятся ядерные частицы—нуклоны двух сортов: положительно заряженные протоны p+ с массой 1,672·10-24г и зарядом 4,803•10-10 эл.-ст. ед. и незаряженные нейтроны по с массой 1,675·10-24г; электроны е- имеют массу 9,108 ·10-28 г и отрицательный заряд 4,803-10-10 эл.-ст. ед. Число электронов в нейтральном атоме всегда равно числу протонов в ядре. Нуклоны связаны между собой мощными силами ближнедействия в виде так называемого мезонного поля. Электроны связываются с ядром, а также между собой силами взаимодействия. Число протонов Z в ядре атомов известных в природе элементов изменяется от 1 до 115, и оно определяет принадлежность атомов к тому или иному химическому элементу начиная от первого - водорода с Z=l и до мейтнерия с Z=109(последний с названием элемент). Число нейтронов N в ядре изменяется от 0 до 146; при одном и том же содержании протонов оно может быть разным. Атомы с одинаковым числом протонов, но отличающиеся друг от друга по числу нейтронов составляют различные изотопы. Сумма протонов и нейтронов, т. е. число нуклонов в ядре M=Z+N, называется массовым числом. При обозначении атомов указываются числа М и Z, тем самым и N, следующим способом,—покажем это на примере водорода и урана, -zНM и zUM; атомы водорода бывают 1H1, 1H2 и 1H3, а атомы урана 92U234, 92U235 и 92U238.
Свойства ядра определяют важнейшие особенности атомов, в частности их устойчивость, т. е. прочность или, наоборот, способность к распаду. Электроны е- вращаются по своим орбитам вокруг ядра, образуя шаровое или более сложно устроенное «электронное облако»(Рис.1.1.1.).
 |
Рис.1.1.1.. Модель электронных орбит в атоме натрия.
Переход электрона с одной орбиты на другую или из одного состояния в другое происходит дискретно и сопровождается поглощением или выбросом кванта энергии(Рис.1.1.2.). Испускаемые кванты в соответствии с величиной волны располагаются в определенную последовательность – спектр.

Рис.1.1.2..Масштабный чертеж пяти низших боровских орбит водорода, иллюстрирующий возможные переходы электрона.
Спектральные линии записываются на фотопленку. Каждый химический элемент имеет свой набор спектральных линий(Рис.1.1.3.).
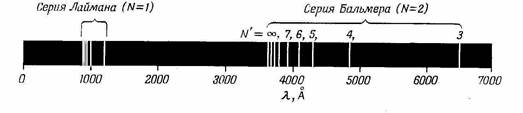
Рис.1.1.3. Энергетические квантовые линии в спектре водорода.
1.2.Свойства электрона.
Энергетическое состояние электрона определяется четырьмя квантовыми числами. Прежде всего оно зависит от главного квантового числа п. Доказано, что значения п отвечают натуральному ряду чисел 1, 2, 3, 4, 5, 6, 7... Соответственно главному квантовому числу электроны формируют вокруг ядра электронные оболочки: первую (n =1), вторую (n =2) и т. п. Далее, имеет значение второе квантовое число l, характеризующее вращение (прецессию) орбиты электрона вокруг ядра. При данном п число l изменяется в виде натурального ряда чисел от 0 до п— 1. Затем, состояние электрона зависит от его магнитного момента, возникающего вследствие вращения по орбите, которое обозначается как ml и изменяется от —/ до +/, будучи всегда целым числом. Наконец, энергетика электрона зависит от его вращения «вокруг своей оси», что характеризуется магнитным спиновым числом или спином т. Это число имеет значения только +1/2 или -1/2.
Итак, электрон энергетически вполне характеризуется четырьмя квантовыми числами: п, I, ml и ms.
У всех электронов в атоме квантовые числа различны. Благодаря этому (или вследствие этого) электроны распределятся по слоям (в зависимости от «n»), по группам электронов (благодаря «l»), электронным ячейкам (благодаря «ml») и по характеру спина электрона (в зависимости от «ms»).
В известных атомах «n» имеет значения от 1,2,3,4,5,6,7, что указывает на образование в атомах до семи электронных слоев, они могут обозначаться также буквами в порядке возрастания: K,L,M,N,O,P,Q.
Значение «l» следовательно может меняться (в соответствии с условием от 0 до n – 1) при разных n, от 0 при n = 1 до 6 при n = 7 (n-1). 7-1=6.
Следовательно, в слое может быть до 6 подгрупп электронов. Подгруппы обозначаются буквами S (l=0); P(l=1), d (l=2), f (l=3)*. Подгруппы 4,5,6 в природных атомах не реализуются.
Значение “ml”, варьирующее от –l до +l, при разных l получается таким:
l = 0 (s- электроны) ml = 0
l = 1 (p-электроны) ml = -1,0,+1
l = 2 (d-электроны) ml = -2,-1,0,+1,+2
l = 3 (f-электроны) ml = -3,-2,-1,0,+1,+2,+3
Это означает, что в подгруппах электроны распределяются по разному числу ячеек: в подгруппе s – в одной, в подгруппе p – в трех, в подгруппе d – в пяти и в подгруппе f – в семи. Ячейки будут обозначаться их цифровыми знаками.
Наконец, электронов в каждой ячейке может быть либо один, называемый неспаренным или холостым, либо два, непременно со спинами ms разного знака +1/2 и –1/2, называемых спаренными; знаки спинов обозначаются стрелками ↓ и ↑, у спаренных ↓↑. Заполнение электронной оболочки вокруг ядра идет по слоям от 1 (K) до 7 (Q).
1.3.Зонная теория вещества.
Энергообмен атома с окружающей средой осуществляется в виде скачкообразного процесса. Он характеризуется переходом электрона от одного разрешенного энергетического cостояния в другое и сопровождается излучением или поглощением кванта энергии. Поведение электронов в структуре атома объясняется зонной теорией вещества. Сущность зонной теории состоит в том, что в различном состоянии электроны обладают разными уровнями энергии.(Рис.1.3.1.).

Рис.1.3.1.Схема энергетических зон в результате расщепления энергетических уровней атома в кристалле.
Эти уровни (или энергетические зоны) имеют различную ширину и распределены следующим образом относительно ядра атома: более широкие энергетические зоны располагаются в направлении возрастания энергии электрона(Е). Одновременно сужаются «запрещенные» зоны. В глубине атома, ближе к ядру, электроны экранированы от влияния прочих атомов кристалла, здесь максимальная ширина запрещенных зон и минимальная – энергетических. Чтобы переместить электрон на более высокий уровень требуется поступление более крупных квантов энергии.
Ближе к внешней оболочке атома, чем дальше электрон от ядра, тем слабее на него действует поле «собственного» ядра, зато ощутимее проявляет себя результирующее поле множества других атомов. Поэтому ширина энергетических зон расширяется, а запрещенных – сужается. Вследствие этого, электроны на внешних оболочках легко переходят от одного атома к другому, т.е. становятся общими.
В целом совокупность строения энергетических зон в кристаллах обусловливает их главные свойства, связанные с поглощением и выделением энергии, такие как плавкость, теплопроводность, электропроводность, магнитность и др. В зависимости от ширины запрещенной зоны меняется внутренняя энергия вещества, которая выражается в электрон-вольтах (рис.1.3.2.). В связи с этим резко меняются электрические свойства и выделяются металлы, полупроводники и изоляторы.
 |
Рис.1.3.2.Энергетические зоны металла(а), полупроводника(б) и изолятора(в).
Свойства химических элементов.
Структуры электронной оболочки атомов всех химических элементов отражены в Периодической системе Менделеева. Глядя на периодическую систему элементов (Приложение 1.4.1.), легко узнать строение атома любого элемента. Порядковый номер каждого элемента в таблице численно равен положительному заряду ядра. Номер периода показывает, сколько электронных слоев имеется вокруг ядра. Номер группы – число валентных электронов на всех энергетических уровнях. Самая нижняя показывает число электронов в ближайшем к ядру слое, самая верхняя – во внешнем. Последовательное заполнение каждого электронного слоя (с соответствующим прибавлением числа протонов в ядре) отвечает формированию определенного периода в системе Д.И.Менделеева (Приложение 1.4.2.).
Строение электронных орбит атомов определяет главные их свойства взаимодействия их между собой и свойства минералов, в которые они входят. В связи с этим в периодической системе выделяется три группы элементов:
1.Элементы, имеющие ясную химическую индивидуальность; атомы этих элементов строятся путем прибавления электрона во внешнем (первом) слое: это элементы первого периода Н и Не, а в каждом последующем периоде их по 8, за исключением последнего оборванного периода. Т.о. это: H,He,Li,Be,B,C,N,O,F и т.д.
2. Элементы, имеющие нечеткую химическую индивидуальность; атомы их строятся путем прибавления электронов не во внешнем, а во втором слое. Это элементы в красных клетках: их по 10 в каждом периоде, начиная с IV периода, кроме 7 периода. Это: Se,Ti,V,Cr,Mn,Fe,Co,Ni,Cu,Zn и т.д.
3.Элементы с близкими (снивелированными) химическими свойствами в пределах периода; атомы их строятся путем прибавления электронов не во внешнем или во втором слое, а глубже - в третьем слое. Таких элементов 14 в VI периоде, и 2 в VII.