Понятие о скорости химической реакции. Факторы, определяющие скорость химической реакции. Катализаторы. Понятие о химическом равновесии. Прямая и обратная реакции. Смещение химического равновесия. Принцип Ле-Шателье.
Химическая кинетика изучает скорость и механизм протекания химических процессов, а также зависимость их от различных факторов. Скорость химической реакции определяется изменением концентрации реагирующих веществ за единицу времени. Различают среднюю и истинную скорости реакции.
Средняя скорость реакции представляет собой уменьшение концентрации исходного вещества, или увеличение концентрации продукта реакции, за единицу времени и определяется по формуле
V= 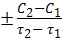 . (2)
. (2)
Истинная скорость реакции в данный момент может быть выражена изменением концентрации исходного вещества или продукта реакции за бесконечно малый промежуток времени. Истинную скорость реакции можно определить следующим образом:
V=  . (3)
. (3)
Скорость реакции всегда считается положительной. Отношения (2) и (3) могут быть положительными или отрицательными, в зависимости от того, как изучают скорость реакции: по изменению концентрации одного из исходных веществ или одного из продуктов реакции (рис. 1).
C
| продукты реакции |
| исходные вещества |
Рис.1. Изменение концентрации исходных веществ и продуктов реакции
в зависимости от времени
Все химические реакции подразделяются на гомогенные (однофазные) и гетерогенные (многофазные). Фазой называется совокупность однородных частей системы, обладающих одинаковыми химическими, физическими, термодинамическими свойствами и отделенных от других частей системы поверхностью раздела:
NaOH(Ж) + HCl(Ж) = NaCl(Ж)+ H2O(Ж) – реакция гомогенная;
Zn(Т) + HCl(Ж) = ZnCl2(Ж) +H2 (Г) – реакция гетерогенная.
Факторы, определяющие скорость химической реакции:
- природа реагирующих веществ. Влияет на скорость химической реакции. Например, металлический натрий вступает в бурную реакцию с водой, а алюминий и цинк с водой практически не взаимодействуют;
- концентрация реагирующих веществ. Закон, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ, называется законом действующих масс.
Представим уравнение химической реакции в общем виде:
mA + nB продукты реакции.
Тогда закон действующих масс можно записать следующим образом:
V = K [A]m 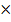 [B]n,
[B]n,
где [A] и [B] – концентрация реагирующих веществ;
m и n – стехиометрические коэффициенты;
K – константа скорости химической реакции, равная скорости химической реакции при концентрациях[A]= [B]=1 моль/л;
- температура. С повышением температуры скорость химической реакции возрастает. Зависимость скорости от температуры выражается законом Вант-Гоффа
VT2= VT1 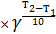 ,
,
где  – температурный коэффициент Вант-Гоффа.
– температурный коэффициент Вант-Гоффа.
Более точно зависимость скорости реакции от температуры описывается уравнением Аррениуса
К = Ко × е-Е/RT,
где К – константа скорости химической реакции;
Ко– эмпирическая постоянная, называемая предэкспоненциальным множителем;
е – основание натурального логарифма;
Е – энергия активации химической реакции;
R – газовая постоянная;
Т – абсолютная температура;
- катализаторы. Катализаторами называют вещества, изменяющие скорость химической реакции, но не входящие в состав ее продуктов. Они могут ускорить (активаторы) или замедлить (ингибиторы) скорость химической реакции. Действие катализатора объясняется тем, что при его участии возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции.
Механизм действия катализатора имеет вид:
А + В АВ;
А + К АК;
АК + В АВ + К.
Химическое равновесие
Все химические реакции можно разделить на две группы – необратимые и обратимые. Необратимые реакции протекают до полного расходования одного из реагирующих веществ. При обратимых реакциях ни одно из реагирующих веществ не расходуется полностью. Это связано с тем, что обратимые реакции могут протекать как в прямом, так и в обратном направлениях:
2KClO3 2KCl + O2 – реакция необратимая;
N2 + 3H2 2 NH3 – реакция обратимая.
Через некоторое время в обратимых химических процессах устанавливается равновесие, т.е. такое состояние, когда скорость прямой реакции становится равной скорости обратной, а концентрация всех веществ, участвующих в реакции, не изменяется во времени.
Количественной характеристикой химического равновесия является константа. Вывод константы для общего случая обратимой реакции:
mA +nB qC + pD,
V1 = K1 ×[A]m × [B]n ; V2 = K2 × [C]q × [D],
V1 = V2,
тогда константа равновесия выражается отношением
Kхр =  =
= 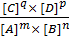 .
.
Константа химического равновесия является постоянной величиной для данной обратимой реакции только при определенной температуре. Смещение химического равновесия подчиняется принципу Ле Шателье, который заключается в следующем: если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие в этой системе смещается в сторону той реакции, которая стремится ослабить это внешнее воздействие.