Билет 10
1.Витамин PP существует в двух формах - никотиновой кислоты и никотиномида. Активное воздействие витамина PP на обменные процессы обусловлено его вхождением в состав ниацинамидадениндинуклеотида (НАД) и ниацинамидадениндинуклеотида фосфата (НАДФ), являющихся кофакторами ряда ферментов. Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ (см. раздел 2). Синтез NAD в организме протекает в 2 этапа:

NADP образуется из NAD путём фосфорилирования под действием цитоплазматической NAD-киназы.
NAD+ + АТФ → NADP+ + АДФ
В частности, ниацинамид входит в состав кодегидраз, являющихся переносчиками водорода к флавопротеиновым ферментам, и тем самым регулирует окислительно-восстановительные процессы в организме. Он участвует более чем в полусотне реакций, в ходе которых сахар и жир превращаются в энергию. Он также необходим для обмена аминокислот и участвует в превращении жиров в вещества, именуемые эйкозаноидами, - гормоноподобные агенты, управляющие метаболическими путями нашего организма. Ниацин - витамин, не знающий равных в контроле холестерина. Ниацин борется с такими факторами риска сердечно-сосудистых заболеваний
Ниацин это белый кристаллический порошок без запаха, слабокислого вкуса. Трудно растворим в холодной воде (1:70), лучше в горячей (1:15), мало растворим в этаноле, очень мало — в эфире.Суточная потребность взрослого человека 15—20 мг.
Источники. Витамин РР широко распространён в растительных продуктах, высоко его содержание в рисовых и пшеничных отрубях, дрожжах, много витамина в печени и почках крупного рогатого скота и свиней. Витамин РР может образовываться из триптофана (из 60 молекул триптофана может образоваться 1 молекула никотинамида), что снижает потребность в витамине РР при увеличении количества триптофана в пище.
Недостаточность витамина РР приводит к заболеванию "пеллагра", для которого характерны 3 основных признака: дерматит, диарея, деменция ("три Д"), Пеллагра проявляется в виде симметричного дерматита на участках кожи, доступных действию солнечных лучей, расстройств ЖКТ (диарея) и воспалительных поражений слизистых оболочек рта и языка. В далеко зашедших случаях пеллагры наблюдают расстройства ЦНС (деменция): потеря памяти, галлюцинации и бред.
2. Гликоген служит в животном организме резервом углеводов, из которого по мере метаболической потребности могут высвобождаться глюкозофосфат или глюкоза. Хранение в организме собственно глюкозы неприемлемо из-за ее высокой растворимости: высокие концентрации глюкозы создают в клетке высоко гипертоническую среду, что приводит к притоку воды. Напротив, нерастворимый гликоген осмотически почти неактивен.
Гликоген животных, как и амилопектин растений, представляет собой разветвленный гомополимер глюкозы, в котором остатки глюкозы соединены α(1→4)-гликозидной связью. Связи в точках ветвления находятся в положении α(1→6) примерно каждого 10-го остатка. Таким образом, возникает древовидная структура с молекулярной массой >1ּ107 Да (до 50 000 остатков), в которой имеется только одна свободная аномерная ОН-группа, т. е. только один восстанавливающий конец. 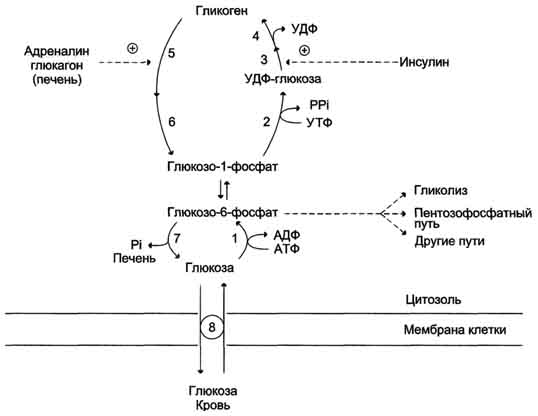
Синтез и распад гликогена. 1 - гексокиназа или глюкокиназа (печень); 2 - УДФ-глюкопирофосфорилаза; 3 - гликогенсинтаза; 4 - амило-1,4 → 1,6-глюкозилтрансфераза (фермент ветвления); 5 - гликогенфосфорилаза; 6 - "деветвящий" фермент; 7 - глюкозо-6-фосфатаза (печень); 8 - транспортные системы ГЛЮТ.
Гликоген печени никогда не расщепляется полностью. Как правило, укорачиваются или удлиняются (при высоком содержании глюкозы) только невосстанавливающие концы древовидной структуры. Удлинение цепи катализируется гликоген-синтазой [2]. Так как образование гликозидных связей между сахарами является эндоэргической реакцией, вначале в реакции глюкозо-1-фосфата с уридинтрифосфатом [УТФ (UTP)] образуется активированный предшественник — УДФ-глюкоза (UDP-глюкоза) ([1]). После этого остаток глюкозы легко переносится с этого промежуточного соединения на гликоген. Когда растущая цепь достигает определенной длины (>11 остатков), специальный фермент ветвления гликогена (1,4→1,6-трансгликозидаза) [3] катализирует перенос концевого олигосахарида, состоящего из 6-7 остатков, на 6-ОН остаток глюкозы той же или другой цепи гликогена с образованием точки ветвления [α(1→6)-связи] Дальнейшее удлинение этого фрагмента осуществляется гликоген-синтазой, образующей α(1→4)-связи.
Разветвленная структура гликогена облегчает быстрое освобождение углеводных остатков. Наиболее важным ферментом деградации гликогена является гликоген-фосфорилаза [4], отщепляющая от невосстанавливающего конца цепи остатки глюкозы в виде глюкозо-1-фосфата. Чем больше таких концов, тем больше молекул фосфорилазы могут действовать одновременно. Образование глюкозо-1-фосфата вместо глюкозы имеет то преимущество, что для включения освобожденных остатков глюкозы в гликолиз или ГМП не требуется АТФ.Благодаря структуре гликоген-фосфорилазы, процесс последовательного отщепления останавливается за 4 остатка глюкозы от точки разветвления. Точки ветвления удаляются двумя другими ферментами [5 и 6]. Вначале трисахарид боковой цепи переносится [5] к невосстанавливающему концу главной цепи. Затем 1,6-гликозидаза [6] отщепляет остающийся единичный остаток глюкозы в точке ветвления в виде свободной глюкозы, после чего неразветвленная цепь, может вновь расщепляться фосфорилазой.
В организме человека может содержаться до 450 г гликогена, треть из которого накапливается в печени, а остальное — главным образом в мышцах. Содержание гликогена в других органах незначительно. Гликоген печени служит прежде всего для поддержания уровня глюкозы в крови в фазе пострезорбции. Поэтому содержание гликогена в печени варьирует в широких пределах. При длительном голодании оно падает почти до нуля, после чего начинается снабжение организма глюкозой с помощью глюконеогенеза. Гликоген мышц служит резервом энергии и не участвует в регуляции уровня глюкозы в крови. В мышцах отсутствует глюкозо-6-фосфатаза, поэтому гликоген мышц не может быть источником глюкозы в крови. По этой причине колебания содержания гликогена в мышцах меньше, чем в печени.
Фосфоролиз является основным путем распада гликогена, его катализирует фермент гликогенфосфорилаза, относящийся к классу трансфераз. Гликогенфосфорилаза отщепляет остатки глюкозы с нередуцирующего конца гликогена и переносит их на молекулу фосфорной кислоты с образованием глюкозо-1-фосфата:
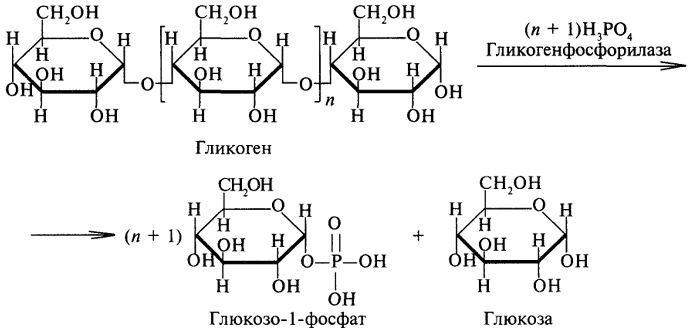
Глюкозо-1-фосфат быстро изомеризуется, превращаясь в глюкозо-6-фосфат, который в печени гидролизуется фосфатазами до глюкозы и фосфорной кислоты:
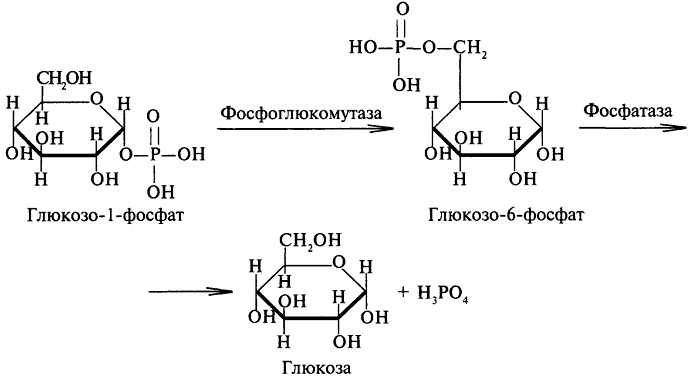
Процесс фосфоролиза гликогена тонко регулируется. Регуляция активности гликогенфосфорилазы носит каскадный характер, в котором можно выделить несколько видов регуляции ферментативной активности:
1) гормональная (глюкагон в печени, адреналин в мышцах);2) аллостерическая;3) протеинкиназные реакции (в данном случае - фосфорилирование бокового радикала серина в гликогенфосфорилазе).
Активность мышечной фосфорилазы увеличивается при определенной концентрации АМФ и ацетилхолина, а также в присутствии катионов кальция и натрия.Снижение скорости фосфоролиза происходит при уменьшении запасов гликогена и фосфорной кислоты, а также при увеличении концентрации глюкозо-6-фосфата. Механизмы, снижающие скорость фосфоролиза гликогена, предохраняют организм от больших трат углеводных запасов (гликогена), которые могли бы привести к недостатку глюкозы, необходимой для работы головного мозга и сердечной мышцы.
3. Клеточная мембрана - это неотъемлемый компонент любой клетки. Ее роль в первую очередь состоит в том, чтобы отграничить внутреннее пространство клетки от внешней среды, а у эукариот, кроме того, разделить внутреннюю часть клетки на функционально значимые отсеки: ядро и митохонодрии. В мембранах содержатся липиды трех классов: фосфолипиды, холестерин и гликолипиды. Наиболее важная группа, фосфолипиды, включает фосфатидилхолин (лецитин), фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит и сфингомиелин. Холестерин присутствует во внутриклеточных мембранах животных клеток (за исключением внутренней мембраны митохондрий). Гликолипиды входят в состав многих мембран (например, во внешний слой плазматических мембран). В состав гликолипидов входят углеводные функциональные группы которые ориентируются в водную фазу.
Липиды мембран представляют собой амфифильные молекулы с полярной гидрофильной головкой (голубого цвета) и неполярным липофильным хвостом (желтого цвета). В водной среде они агрегируют за счет гидрофобных взаимодействий и вандерваальсовых сил.
Даниелли в связи с необходимостью объяснить явное расхождение между поверхностным натяжением на границах раздела масло/вода и мембра-на/вода. Была высказана гипотеза, что мембрана состоит из двойного липидного слоя, и предположено, что белок располагается на ее поверхности – модель Даниели – Дэвсона, или модель «сэндвича»). Это была очень удачная модель, и в течение последующих 30 лет многочисленные экспериментальные данные, особенно полученные с помощью дифракции рентгеновских лучей и электронной микроскопии, полностью подтвердили ее адекватность. Основными компонентами биологической мембраны являются липид и белок, вопрос о взаимном расположении этих компонентов в мембране стал предметом многочисленных дискуссий, так как обнаружилось, что мембраны выполняют разнообразные функции.
ЖИДКОСТНО-МОЗАИЧНАЯ МОДЕЛЬ МЕМБРАН КЛЕТКИ
Данная модель основана на предшествующих моделях структурно-функциональной организации мембран клетки. Живаямембрана представляет собой двумерный раствор глобулярных интегральных белков, диспергированных в жидкомфосфолипидном матриксе. Экспериментальные подтверждения данного предположения были получены при искусственно вызванном слиянии двух разных родительских клеток. При образовании плазматической мембраны гибридной клетки происходит быстрое стохастическое перемещение с систематическим упорядочением видоспецифичных белков и фосфолипидов. Такие перемещения в плоскости мембраны были названы латеральной подвижностью (диффузией) компонентов мембран.
Билет 11
1. Витамин В6(пиридоксин, пиридоксаль,
пиридоксамин)
В основе структуры витамина В6 лежит пиридиновое кольцо. Известны 3 формы витамина В6, отличающиеся строением замещающей группы у атома углерода в п-положении к атому азота. Все они характеризуются одинаковой биологической активностью.

Рис. 3-1. Строение КоА и 4'-фосфопантотеина. 1 - тиоэтаноламин; 2 - аденозил-3'-фосфо-5'-дифосфат; 3 - пантотеновая кислота; 4 - 4'-фосфопантотеин (фосфорилированная пантотеновая кислота, соединённая с тиоэтаноламином).
Все 3 формы витамина - бесцветные кристаллы, хорошо растворимые в воде.
Источники витамина В6 для человека - такие продукты питания, как яйца, печень, молоко, зеленый перец, морковь, пшеница, дрожжи. Некоторое количество витамина синтезируется кишечной флорой.
Суточная потребность составляет 2-3 мг.
Биологические функции. Все формы витамина В6 используются в организме для синтеза кофер-ментов: пиридоксальфосфата и пиридоксаминфосфата. Коферменты образуются путём фос-форилирования по гидроксиметильной группе в пятом положении пиримидинового кольца при участии фермента пиридоксалькиназы и АТФ как источника фосфата.
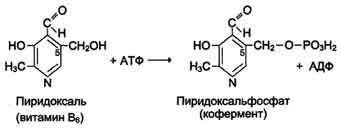
Пиридоксалевые ферменты играют ключевую роль в обмене аминокислот: катализируют реакции трансаминирования и декарбоксилирования аминокислот, участвуют в специфических реакциях метаболизма отдельных аминокислот: серина, треонина, триптофана, серосодержащих аминокислот, а также в синтезе тема (см. разделы 9, 12).
Клинические проявления недостаточности витамина. Авитаминоз В6 у детей проявляется повышенной возбудимостью ЦНС, периодическими судорогами, что связано, возможно, с недостаточным образованием тормозного медиатора ГАМК (см. раздел 9), специфическими дерматитами. У взрослых признаки гиповитаминоза В6 наблюдают при длительном лечении туберкулёза изониазидом (антагонист витамина В6). При этом возникают поражения нервной системы (полиневриты), дерматиты.
2. Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). Следует отметить, что синтез гликогена из глюкозы, как и любой анаболический процесс, является эндергоническим, т.е. требующим затрат энергии. Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата. Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФ-глюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата.
Реакция образования УДФ-глюкозы обусловливает необратимость всей серии реакций, протекающих при синтезе гликогена. Этим же объясняется невозможность протекания распада
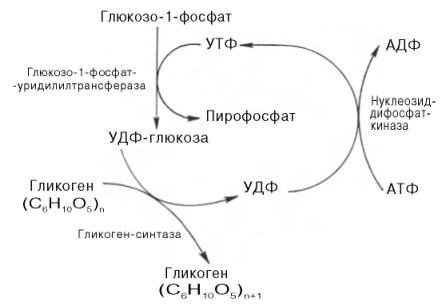
Образование УДФ-глюкозы.
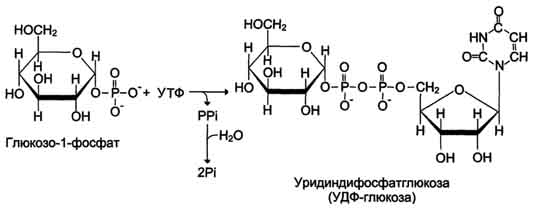
Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена. Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Поскольку в данной реакции не используется АТФ, фермент называют син-тазой, а не синтетазой. Нуклеотидная часть УДФ-глюкозы играет существенную роль в действии гликоген синтазы, выполняя функцию "рукоятки", при помощи которой фермент располагает глюкозу в полисахаридной цепи в нужном положении. Кроме того, нуклеотидная часть УДФ-глюкозы, по-видимому, необходима для узнавания субстрата при катализе.
Так как гликоген в клетке никогда не расщепляется полностью, синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой "затравка" или "праймер". К "затравке" последовательно присоединяются молекулы глюкозы. Строением молекулы "затравки" как бы предопределяется тип связи, который возникает в реакции трансгли-козилирования. Таким образом, синтезируется полисахарид, аналогичный по строению с "затравочным". В состав "затравки" может входить белок гликогенин, в котором к ОН-группе одного из тирозиновых остатков присоединена олигосахаридная цепочка (примерно 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. По окончании синтеза гликогенин остаётся включённым в гранулу гликогена.
Разветвлённая структура гликогена образуется при участии амило-1,4 →1,6-глюкозилтрансферазы, называемой ферментом "ветвления" (от англ, branching enzyme). Как только гликогенсинтаза удлиняет линейный участок примерно до 11 глюкозных остатков, фермент ветвления переносит её концевой блок, содержащий 6-7 остатков, на внутренний остаток глюкозы этой или другой цепи. В точке ветвления концевой остаток глюкозы олигосахарида соединяется с гидроксильной группой в С6 положении с образованием α-1,6-гликозидной связи. Новая точка ветвления может быть образована на расстоянии не менее 4 остатков от любой уже существующей. Таким образом, по мере синтеза гликогена многократно возрастает число ветвлений. Концы цепей служат точками роста молекулы при её синтезе и началом при её распаде.
Активность гликогенсинтазы также изменяется в результате фосфорилирования и дефосфорилирования (см. выше рис. 7-27). Однако есть существенные различия в регуляции гликогенфосфорилазы и гликогенсинтазы:
- фосфорилирование гликогенсинтазы катализирует ПК А и вызывает её инактивацию;
- дефосфорилирование гликогенсинтазы под действием фосфопротеинфосфатазы, наоборот, её активирует.

3. Аминокислот — эт органически соединения, физико-химическо по
ведени и разнообразны реакци которы объясняютс одновременны
присутствие в молекул основно аминогрупп N H2— и кисло карбо
ксильно групп —СООН.
Билет 12
1. В основе строения биотина лежит тиофено-вое кольцо, к которому присоединена молекула мочевины, а боковая цепь представлена валерьяновой кислотой.
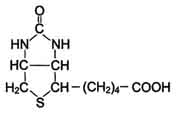
· Источники. Биотин содержится почти во всех продуктах животного и растительного происхождения. Наиболее богаты этим витамином печень, почки, молоко, желток яйца. В обычных условиях человек получает достаточное количество биотина в результате бактериального синтеза в кишечнике.
· Суточная потребность биотина у человека не превышает 10 мкг.
· Биологическая роль. Биотин выполняет коферментную функцию в составе карбоксилаз: он участвует в образовании активной формы СО2.
· 
В организме биотин используется в образовании малонил-КоА из ацетил-КоА (см. раздел 8), в синтезе пуринового кольца (см. раздел 10), а также в реакции карбоксили-рования пирувата с образованием оксало-ацетата (см. раздел 6). Клинические проявления недостаточности биотина у человека изучены мало, поскольку бактерии кишечника обладают способностью синтезировать этот витамин в необходимых количествах. Поэтому картина авитаминоза проявляется при дисбактериозах кишечника, например, после приёма больших количеств антибиотиков или сульфамидных препаратов, вызывающих гибель микрофлоры кишечника, либо после введения в рацион большого количества сырого яичного белка. В яичном белке содержится гликопротеин авидин, который соединяется с биотином и препятствует всасыванию последнего из кишечника. Авидин (молекулярная масса 70 000 кД) состоит из четырёх идентичных субъединиц, содержащих по 128 аминокислот; каждая субъединица связывает по одной молекуле биотина.
· При недостаточности биотина у человека развиваются явления специфического дерматита, характеризующегося покраснением и шелушением кожи, а также обильной секрецией сальных желёз (себорея). При авитаминозе витамина Н наблюдают также выпадение волос и шерсти у животных, поражение ногтей, часто отмечают,боли в мышцах, усталость, сонливость и депрессию.
2. Нарушение обмена гликогена
Основные запасы гликогена находятся в печени и скелетных мышцах. Гликоген печени и мышц расходуется в зависимости от потребностей организма (лабильный гликоген). Гликоген нервных клеток, проводящей системы сердца, аорты, эндотелия, эпителиальных покровов, слизистой оболочки матки, соединительной ткани, эмбриональных тканей, хряща является необходимым компонентом клеток и его содержание не подвергается заметным колебаниям (стабильный гликоген). Однако деление гликогена на лабильный и стабильный условно. Регуляция обмена углеводов осуществляется нейроэндокринным путем. Основная роль принадлежит гипоталамической области, гипофизу (АКТГ, тиреотропный, соматотропный гормоны), бета-клеткам островков поджелудочной железы (инсулин), надпочечникам (глюкокортикоиды, адреналин) и щитовидной железе.
Нарушения содержания гликогена проявляются в уменьшении или увеличении количества его в тканях и появлении там, где он обычно не выявляется. Эти нарушения наиболее ярко выражены при сахарном диабете и при наследственных углеводных дистрофиях - гликогенозах.
При сахарном диабете, развитие которого связывают с патологией бета-клеток островков поджелудочной железы, что обусловливает недостаточную выработку инсулина, происходит недостаточное использование глюкозы тканями, увеличение ее содержания в крови (гипергликемия) и выведение с мочой (глюкозурия). Тканевые запасы гликогена резко уменьшаются. Это в первую очередь касается печени, в которой нарушается синтез гликогена, что ведет к инфильтрации ее жирами - развивается жировая дистрофия печени; при этом в ядрах гепатоцитов появляются включения гликогена, они становятся светлыми (<пустые> ядра).
С глюкозурией связаны характерные изменения почек при диабете. Они выражаются в гликогенной инфильтрации эпителия канальцев, главным образом узкого и дистального сегментов. Эпителий становится высоким, со светлой пенистой цитоплазмой; зерна гликогена видны и в просвете канальцев. Эти изменения отражают состояние синтеза гликогена (полимеризация глюкозы) в канальцевом эпителии при резорбции богатого глюкозой ультрафильтрата плазмы. При диабете страдают не только почечные канальцы, но и клубочки, их капиллярные петли, базальная мембрана которых становится значительно более проницаемой для сахаров и белков плазмы. Возникает одно из проявлений диабетической микроангиопатии - интеркапиллярный (диабетический) гломерулосклероз.
Наследственные углеводные дистрофии, в основе которых лежат нарушения обмена гликогена, называются гликогенозами. Гликогенозы обусловлены отсутствием или недостаточностью фермента, участвующего в расщеплении депонированного гликогена, и относятся потому к наследственным ферментопатиям, или болезням накопления. В настоящее время хорошо изучены 6 типов гликогенозов, обусловленных наследственной недостаточностью 6 различных ферментов. Это болезни Гирке (I тип), Помпе (II тип), Мак-Ардля (V тип) и Герса (VI тип), при которых структура накапливаемого в тканях гликогена не нарушена, и болезни Форбса-Кори (III тип) и Андерсена (IV тип), при которых она резко изменена.