ЭЛЕКТРОХИМИЧЕСКАЯ ЭНЕРГЕТИКА
Методические указания по выполнению контрольных работ
для студентов заочной формы обучения
Факультет электроэнергетический
Направление подготовки 13.03.02 – Электроэнергетика и электротехника
Профиль: «Электроснабжение»
Вологда
УДК 621.355(076)
Электрохимическая энергетика: методические указания по выполнению контрольных работ для студентов заочной формы обучения. - Вологда: ВоГУ, 2017.- 38 с.
Методические указания предназначены для студентов заочной формы обучения направления подготовки 13.03.02 – «Электроэнергетика и электротехника» (профиль «Электроснабжение») по дисциплине «Электрохимическая энергетика». Могут быть использованы студентами очной формы обучения тех же и других направлений и профилей подготовки для самостоятельной работы.
Утверждено редакционно-издательским советом ВоГУ
Составители: С.Б. Мальцева, канд. техн. наук, доцент;
Л.М. Воропай, канд. хим. наук, доцент;
О.П. Ерехинская, ассистент, зав. лабораторией.
Рецензент Л.А. Кузина, канд. физ.-мат. наук, доцент кафедры физики ВоГУ
 |
Содержание
ВВЕДЕНИЕ....................................................................................................... 4
1 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ...................................................... 5
2. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА........................................................ 8
2.1 Гальванические элементы..................................................................... 8
2.2 Топливные элементы.............................................................................. 9
2.3 Аккумуляторы......................................................................................... 9
2.4 Электрохимические характеристики ХИТ........................................ 10
2.5 Связь между химической и электрической энергиями в ХИТ........ 12
3. ПРИМЕРЫРЕШЕНИЯ ЗАДАЧ................................................................. 14
4. КОНТРОЛЬНЫЕ ЗАДАНИЯ..................................................................... 19
БИБЛИОГРАФИЧЕСКИЙ СПИСОК............................................................. 34
ПРИЛОЖЕНИЯ............................................................................................... 36
ВВЕДЕНИЕ
В настоящих методических указаниях приведен теоретический материал по основным разделам дисциплины «Электрохимическая энергетика», основные формулы, необходимые для решения задач, с пояснениями к ним, рассмотрены примеры решения задач, предложены контрольные задания.
В Приложениях приводятся справочные материалы.
Методические указания предназначены для студентов V курса заочной формы обучения.
Могут быть использованы для самостоятельной работы студентами IV курса очной формы обучения направления подготовки 13.03.02 – «Электроэнергетика и электротехника» (профиль «Электроснабжение») по дисциплинам «Электрохимическая энергетика», «Коррозия и защита электротехнического оборудования».
Студенты других направления и профилей подготовки также могут использовать данные указания при изучении раздела «Электрохимия» в курсах «Химия», «Физическая и коллоидная химия» для самостоятельной работы.
1 Электрохимические процессы
Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами.
Электрохимические процессы можно разделить на две основные группы:
1) процессы превращения химической энергии в электрическую, протекающие в электрохимических устройствах, называемых химическими источниками тока;
2) процессы превращения электрической энергии в химическую, протекающие в электрохимических устройствах, называемых электролизерами.
Второй тип электрохимических процессов происходит и при зарядке вторичных источников тока (аккумуляторов).
Простейшее электрохимическое устройство (система, ячейка) состоит из двух электродов, внешней и внутренней цепей. Электродом называют проводник 1-го рода, находящийся в контакте с ионным проводником (проводником 2-го рода). Внешняя цепь – это металлический проводник, соединяющий электроды и обеспечивающий прохождение тока между ними. Внутренняя цепь – это ионный проводник между электродами (растворы или расплавы электролитов, а также твердые электролиты).
Процессы окисления (отдачи электронов) в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами. Процессы восстановления (присоединения электронов) в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами. Анодный и катодный процессы называют электродными процессами или электродными реакциями.
Суммарную химическую реакцию, протекающую в химическом источнике тока, благодаря которой возникает электрический ток, называют токообразующей.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называют равновесным электродным потенциалом или просто электродным потенциалом. Электродный потенциал данного электродного процесса при активностях всех участвующих в нем веществ, равных единице, называется стандартным (или нормальным) электродным потенциалом. Стандартные электродные потенциалы ряда электродов относительно водородного электрода сравнения приведены в приложении 1. В этом случае сами электроды часто называют стандартными электродами.
Величины потенциалов различных электродных процессов зависят от следующих факторов:
1) от природы веществ – участников электродного процесса;
2) от соотношения между активностями этих веществ;
3) от температуры системы.
Эта зависимость выражается уравнением Нернста:
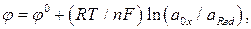 (1)
(1)
где 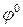 – стандартный электродный потенциал данного процесса (электрода);
– стандартный электродный потенциал данного процесса (электрода);
R – газовая постоянная;
Т – абсолютная температура;
n – число электронов, принимающих участие в процессе;
F – постоянная Фарадея;
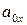 – произведение активностей веществ, участвующих в процессе в окисленной форме;
– произведение активностей веществ, участвующих в процессе в окисленной форме;
 – произведение активностей веществ, участвующих в процессе в восстановленной форме.
– произведение активностей веществ, участвующих в процессе в восстановленной форме.
Рассмотрим, какой вид принимает уравнение Нернста для металлических, газовых и окислительно-восстановительных (редокс-) электродов.
Для расчета потенциала металлического электрода, на границе раздела фаз которого протекает реакция 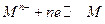 , уравнение Нернста принимает вид:
, уравнение Нернста принимает вид:
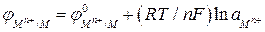 . (2а)
. (2а)
После перехода от натуральных логарифмов к десятичным и подстановки постоянных для температуры 298 К получаем:
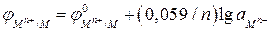 . (2б)
. (2б)
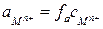 , (3)
, (3)
где 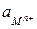 - активность (эффективная концентрация ионов
- активность (эффективная концентрация ионов 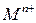 );
);
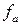 - коэффициент активности (<1);
- коэффициент активности (<1);
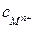 - молярная концентрация ионов
- молярная концентрация ионов  .
.
В очень разбавленных растворах 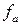 »1 и
»1 и 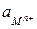 »
» 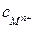 .
.
В этом случае потенциал электрода с некоторой долей приближения может быть рассчитан по уравнению:
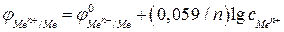 . (2в)
. (2в)
(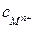 часто обозначают
часто обозначают 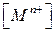 ).
).
Уравнение для расчета потенциала водородного электрода, в котором протекает реакция:
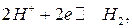
имеет вид:
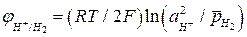 , (4а)
, (4а)
где 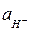 - активность ионов Н+ в электролите;
- активность ионов Н+ в электролите;
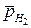 - относительное парциальное давление водорода.
- относительное парциальное давление водорода.
Учитывая, что 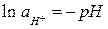 (рН – водородный показатель среды), и после подстановки постоянных для температуры 298 К получаем:
(рН – водородный показатель среды), и после подстановки постоянных для температуры 298 К получаем:
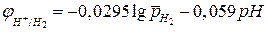 , (4б)
, (4б)
а для 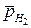 =1:
=1:
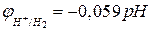 . (4в)
. (4в)
Если на кислородном электроде на границе раздела фаз протекает реакция по уравнению:
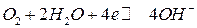 ,
,
то уравнение Нернста для расчета равновесного потенциала кислородного электрода при 298 К имеет вид:
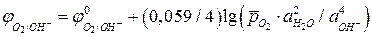 . (5а)
. (5а)
Так как активность воды в ходе реакции меняется мало, то ее считают величиной постоянной и значение 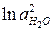 вводят в выражение для
вводят в выражение для 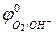 , получая уравнение:
, получая уравнение:
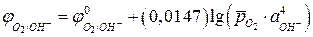 , (5б)
, (5б)
где 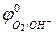 - стандартный потенциал кислородного электрода, равный 0,401 В.
- стандартный потенциал кислородного электрода, равный 0,401 В.
Заменяя 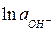 на -
на -  (рОН – гидроксильный показатель среды), получаем при
(рОН – гидроксильный показатель среды), получаем при 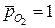 :
:
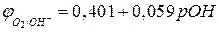 . (5в)
. (5в)
Аналогичные уравнения для расчета кислородного электрода можно получить при восстановлении кислорода в кислой среде:
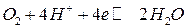 ,
,
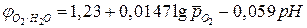 . (6)
. (6)
В общем виде равновесие на редокс-электроде для простых систем записывается уравнением:
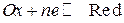 .
.
Уравнение Нернста для расчета потенциала редокс-электрода имеет вид:
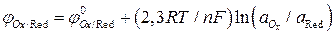 . (7)
. (7)
В случае участия в редокс-процессах ионов  или
или 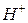 редокс-потенциалы, как и потенциалы кислородного и водородного электродов, зависят от рН. Например, для системы
редокс-потенциалы, как и потенциалы кислородного и водородного электродов, зависят от рН. Например, для системы
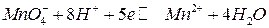 ,
,
в которой ионы 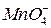 - являются окисленной формой вещества, а ионы
- являются окисленной формой вещества, а ионы 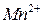 - восстановленной формой вещества, потенциал определяется уравнением:
- восстановленной формой вещества, потенциал определяется уравнением:
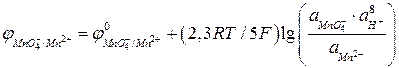 .
.
Преобразуя это уравнение для температуры 298 К, получим:
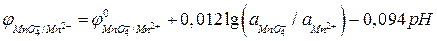 .
.
2 Химические источники тока
Одним из наиболее перспективных является электрохимический способ преобразования химической энергии в электрическую, который осуществляется в химических источниках тока (ХИТ). К достонствам последних относится высокий КПД, бесшумность, безвредность, возможность использования в космосе и под водой, в переносных устройствах, на транспорте и т.п. К химическим источникам тока относятся гальванические элементы, аккумуляторы и топливные элементы.
2.1 Гальванические элементы
Гальваническими первичными элементами называют устройствф для прямого преобразования химической энергии заключенных в них реагентов в электрическую энергию. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента (ГЭ) и расходуются в процессе его работы. После расхода реагентов элемент не может больше работать. Таким образом, это источник тока одноразового действия непрерывного или с перерывами, поэтому его еще называют первичным ХИТ. Восстановителями (анодами) обычно служат цинк, литий и магний, окислителями (катодами) - оксиды металлов (марганца, меди, серебра) и серы, хлориды (меди и свинца), сульфиды железа, а также кислород воздуха и пр. В ГЭ анод – электрод с более отрицательным потенциалом (отрицательный электрод), а катод – электрод с более положительным потенциалом (положительный электрод).
Наиболее массовым является производство сухих марганцево-цинковых элементов, широко применяемых для питания радиоаппаратуры, аппаратуры связи, магнитофонов, карманных фонарей и др. Схема элемента с солевым электролитом:
 .
.
На аноде происходит окисление цинка, на катоде Mn (IV) восстанавливается до Mn (III). Суммарное уравнение токообразующей реакции:
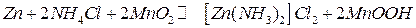 .
.
Для создания гальванического элемента можно использовать электроды из одного материала и раствор одного вещества, но разной концентрации. В этом случае гальванический элемент называется концентрационным.
Гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью, энергией, которую он может отдать во внешнюю цепь, а также сохраняемостью.
2.2 Топливные элементы
Если окислитель и восстановитель хранятся вне элемента и в процессе работы подаются к электродам, которые не расходуются, то элемент может работать длительное время. Такие элементы называются топливными (ТЭ). В топливных элементах химическая энергия восстановителя (топлива) и окислителя, непрерывно и раздельно подаваемых к электродам, непосредственно превращается в электрическую энергию. В ТЭ используют жидкие или газообразные восстановители (водород, метанол, метан) и окислители, обычно кислород воздуха.
Одним из наиболее распространенных ТЭ является кислородно-водородная система со щелочным электролитом. Схема кислородно-водородного ТЭ может быть записано в виде:
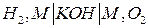 ,
,
где М – проводник 1-го рода, играющий роль катализатора электродного процесса и токоотвода.
На аноде элемента протекает реакция окисления водорода по уравнению:
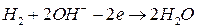 .
.
На катоде восстанавливается кислород:
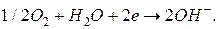
Суммированием уравнений анодной и катодной реакций получаем уравнение токообразующей реакции:
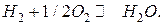
В кислородно-метановом ТЭ происходят следующие электродные реакции:

Топливные элементы характеризуются ЭДС, напряжением, мощностью и КПД.
2.3 Аккумуляторы
Устройства, в которых электрическая энергия превращается в химическую, а химическая – снова в электрическую, называют аккумуляторами. В аккумуляторах под воздействием внешнего источника тока накапливается (аккумулируется) химическая энергия, которая затем переходит в электрическую энергию. Процесс накопления химической энергии называется зарядом аккумулятора, процесс превращения химической энергии в электрическую – разрядом аккумулятора. При заряде аккумулятор работает как электролизер, при разряде — как гальванический элемент. Процессы заряда и разряда аккумуляторов осуществляются многократно.
Аккумулятор в наиболее простом виде имеет два электрода (анод и катод) и ионный проводник между ними. На аноде как при разряде, так и при заряде протекают реакции окисления, на катоде — реакции восстановления.
В настоящее время наиболее распространенными являются свинцовые аккумуляторы, в которых в качестве электролита используется раствор H2SO4, поэтому они называются еще кислотными. При работе на аноде протекают реакции, при которых степень окисления свинца меняется от 2 до 0 и обратно:
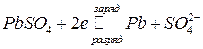 ,
,
а на другом электроде (катоде) степень окисления свинца меняется от 2 до 4 и обратно:
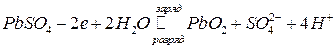 .
.
Суммарная реакция в аккумуляторе:
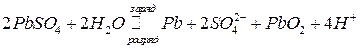 .
.
Промышленность выпускает также щелочные аккумуляторы. Наиболее распространенные из них никель-кадмиевые и никель-железные аккумуляторы. Положительный электрод содержит гидрооксид никеля (гидратированный оксид Ni (III)), отрицательный электрод - соответственно кадмий или железо. Ионным проводником служит 20-23%-ный раствор КОН. Суммарные реакции в наиболее простом виде можно записать уравнениями:
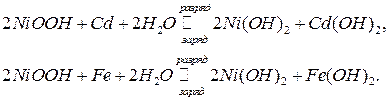
Аккумуляторы характеризуются ЭДС, напряжением, емкостью, энергией и их удельными (на единицу массы и объема) значениями, КПД (отношением энергии, полученной при разряде, к энергии, подведенной при заряде), сроком службы (в годах или количествах разрядно-зарядных циклов) и стоимостью.
2.4 Электрохимические характеристики ХИТ
Электродвижущая сила (ЭДС) – энергетическая характеристика, которая равна разности потенциалов на электродах источника энергии (разности равновесных потенциалов катода 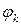 и анода
и анода 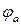 ) при разомкнутой внешней цепи, т.е. при отсутствии электрического тока в источнике:
) при разомкнутой внешней цепи, т.е. при отсутствии электрического тока в источнике:
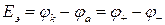 . (8а)
. (8а)
Выражается в вольтах (В).
Разность стандартных потенциалов равна стандартной ЭДС 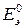 :
:
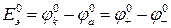 . (8б)
. (8б)
Напряжение химического источника тока U - разность потенциалов положительного и отрицательного электродов при замкнутой внешней цепи. Выражается в вольтах (В).
Емкость элемента – это количество электричества Q, которое источник тока отдает при разряде. Выражается в кулонах (Кл) или ампер-часах (A×ч).
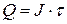 , (9)
, (9)
где Q – емкость, Кл (или А×ч);
J – разрядный ток, А;
t – продолжительность разряда, с (или ч).
Емкость (количество электричества) может быть рассчитано по объединенному уравнению двух законов Фарадея:
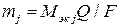 , (10)
, (10)
где 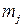 – масса прореагировавшего (или выделившегося) на электроде j -го вещества, г;
– масса прореагировавшего (или выделившегося) на электроде j -го вещества, г;
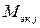 – молярная масса эквивалента j -го вещества, г/моль экв;
– молярная масса эквивалента j -го вещества, г/моль экв;
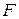 – постоянная Фарадея, »96500 Кл/моль экв.
– постоянная Фарадея, »96500 Кл/моль экв.
Для сравнивания ХИТ используется удельная емкость, т.е. емкость, отнесенная к единице массы 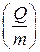 или объема
или объема 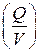 ХИТ.
ХИТ.
На практике при протекании на электроде нескольких параллельных реакций фактическая масса превращенного j -го вещества 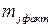 меньше, чем рассчитанная
меньше, чем рассчитанная 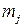 , т.к. на превращение j -го вещества в этом случае тратится лишь определенная доля общего количества прошедшего электричества
, т.к. на превращение j -го вещества в этом случае тратится лишь определенная доля общего количества прошедшего электричества 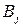 , называемая выходом по току вещества
, называемая выходом по току вещества 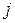 :
:
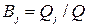 (11а)
(11а)
или 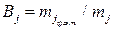 . (11б)
. (11б)
Для случая, когда 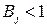 , уравнение (10) записывают в следующем виде:
, уравнение (10) записывают в следующем виде:
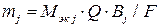 . (12)
. (12)
Энергия элемента W – количество энергии, которое при разряде передается во внешнюю цепь; равна произведению его емкости на напряжение:
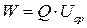 , (13)
, (13)
где 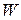 – энергия, Вт×с;
– энергия, Вт×с;
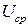 – среднее напряжение разряда, В;
– среднее напряжение разряда, В;
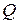 – емкость, Кл.
– емкость, Кл.
Максимальная теоретическая энергия элемента 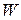 (Вт×с):
(Вт×с):
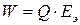 , (14)
, (14)
где 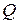 – максимальное количество электричества, которое может отдать элемент, Кл;
– максимальное количество электричества, которое может отдать элемент, Кл;
Еэ – ЭДС элемента.
Для сравнения элементов используется удельная энергия, т.е. энергия, отнесенная к единице массы 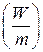 или объема элемента
или объема элемента 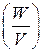 . Теоретическая удельная энергия
. Теоретическая удельная энергия 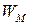 (Вт×с/г), получаемая с единицы массы окислителя
(Вт×с/г), получаемая с единицы массы окислителя 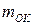 и восстановителя
и восстановителя 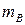 , равна
, равна
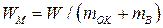 . (15)
. (15)
Мощность источника тока Р – это количество энергии, отдаваемое в единицу времени (Вт):
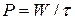 . (16)
. (16)
Сохраняемостью называют срок хранения элемента, в течение которого его характеристики остаются в заданных пределах.
Саморазряд 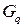 – уменьшение емкости источника тока при хранении с разомкнутой цепью. Выражается в % от емкости в сутки или месяц.
– уменьшение емкости источника тока при хранении с разомкнутой цепью. Выражается в % от емкости в сутки или месяц.
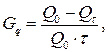 (17)
(17)
где 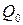 – емкость свежезаряженного источника тока;
– емкость свежезаряженного источника тока;
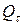 – емкость источника тока после хранения в течение времени t;
– емкость источника тока после хранения в течение времени t;
t – время хранения ХИТ.
2.5 Связь между химической и электрической энергиями в ХИТ
Электродвижущая сила элемента 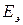 связана с изменением энергии Гиббса
связана с изменением энергии Гиббса 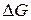 токообразующий реакции соотношением:
токообразующий реакции соотношением:
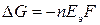 , (18а)
, (18а)
где 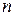 – число молей электронов, участвующих в токообразующей реакции (или число переданных электронов в элементарном акте токообразующей реакции);
– число молей электронов, участвующих в токообразующей реакции (или число переданных электронов в элементарном акте токообразующей реакции);
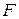 – постоянная Фарадея.
– постоянная Фарадея.
Уравнение (18а) показывает связь между химической и электрической энергиями.
Изменение энергии Гиббса реакции 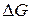 зависит от активностей или парциальных давлений реагентов и продуктов реакции.
зависит от активностей или парциальных давлений реагентов и продуктов реакции.
При стандартных состояниях веществ, т.е. при активностях или относительных парциальных давлениях реагентов и продуктов реакции, равных единице, имеем:
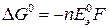 , (18б)
, (18б)
где 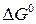 – изменение стандартной энергии Гиббса реакции;
– изменение стандартной энергии Гиббса реакции;
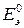 – стандартная ЭДС элемента.
– стандартная ЭДС элемента.
Стандартной (или нормальной) называют ЭДС элемента, в котором относительные парциальные давления исходных веществ и продуктов реакции или их активности равны единице.
Изменение стандарной энергии Гиббса 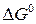 легко рассчитать, зная энергию Гиббса образования или энтальпию образования и энтропию продуктов реакции и исходных веществ (приложение 2).
легко рассчитать, зная энергию Гиббса образования или энтальпию образования и энтропию продуктов реакции и исходных веществ (приложение 2).
Для стандартной температуры (298 К):
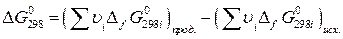 , (19)
, (19)
где 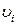 – соответствующие стехнометрические коэффиценты;
– соответствующие стехнометрические коэффиценты;
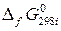 – стандартная энергия Гиббса образования i -го участника реакции.
– стандартная энергия Гиббса образования i -го участника реакции.
Изменение страндартной энергии Гиббса 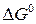 можно также рассчитать по уравнению:
можно также рассчитать по уравнению:
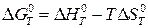 , (20а)
, (20а)
где 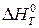 – изменение энтальпии системы в ходе реакции;
– изменение энтальпии системы в ходе реакции;
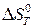 – изменение энтропии системы в ходе реакции.
– изменение энтропии системы в ходе реакции.
Пренебрегая влиянием температуры на величины 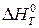 и
и 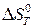 , запишем:
, запишем:
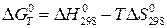 . (20б)
. (20б)
 и
и 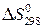 находят по известным формулам:
находят по известным формулам:
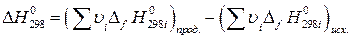 (21)
(21)
и 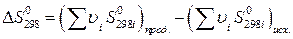 , (22)
, (22)
где 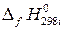 – стандартная энтальгия образования i -го участника реакции;
– стандартная энтальгия образования i -го участника реакции;
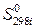 – абсолютная стандартная энтропия i -го участника реакции.
– абсолютная стандартная энтропия i -го участника реакции.
Для расчетов константы равновесия токообразующей реакции, протекающей в химическом источнике тока, часто применяют уравнения:
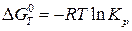 ; (23а)
; (23а)
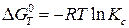 ; (23б)
; (23б)
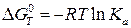 , (23в)
, (23в)
где 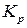 ,
, 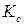 ,
, 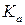 – константы равновесия, выраженные соответственно через парциальные давления, молярные концентрации или активности участников реакции.
– константы равновесия, выраженные соответственно через парциальные давления, молярные концентрации или активности участников реакции.
3 ПРИМЕРЫРЕШЕНИЯ ЗАДАЧ
Пример 1. Рассчитать равновесный потенциал электрода, на котором протекает реакция по уравнению:
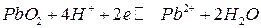 .
.
Активность ионов 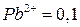 моль/л;
моль/л;
рН=10; Т=298 К.
Решение.
По уравнению Нернста (1):
 .
.
Активность веществ в твердом виде и активность воды принимаются постоянными и учитываются в значении 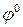 . Уравнение упрощается:
. Уравнение упрощается:
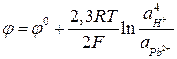
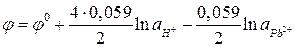
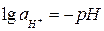
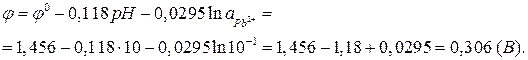
Пример 2. Определить ЭДС концентрационного медного элемента с активностями ионов меди, равными 10-3 моль/л у одного электрода и 10-1 моль/л у другого при 298 К.
Решение.
Схема концентрационного элемента (концентрационной цепи):
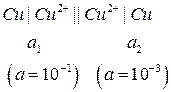
В соответствии с уравнением Нернста (2б):
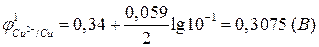 .
.
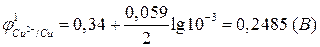 .
.
Из сравнения потенциалов делаем вывод, что первый электрод является катодом (или положительным электродом), а второй электрод – анодом (или отрицательным электродом). Теперь можно в схеме указать знаки электродов и поместить, как принято, отрицательный электрод слева.
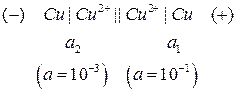
ЭДС равна (8а):
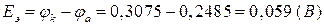 .
.
Электродные процессы: (-) (анод) 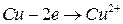
(+) (катод) 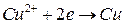 .
.
Пример 3. Гальванический элемент составлен по схеме:
 .
.
Рассчитать ЭДС этого элемента, написать уравнения электродных реакций и суммарную (токообразующую) реакцию, за счет которой работает гальванический элемент.
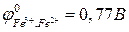 (Приложение 1).
(Приложение 1).
Решение.
По уравнению Нернста (2в):
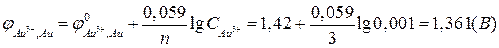 .
.
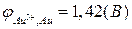 (Приложение 1).
(Приложение 1).
 .
.
Уравнения реакций:
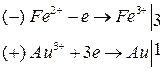
Суммарная реакция:
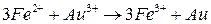 .
.
Пример 4. Составить схему гальванического элемента, в котором протекает реакция:
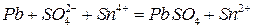 .
.
Решение.
Из справочной таблицы (Приложение 1) выписываем полуреакции, протекающие на электродах, со своими электродными потенциалами и соответствующие электроды:
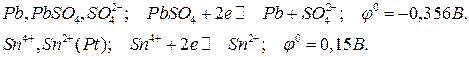
Сравнивая электродные потенциалы найденных электродов, делаем вывод, что отрицательным электродом (анодом) будет первый (на котором протекает первая полуреакция), а положительным (катодом) – второй (на котором протекает вторая полуреакция). На аноде идет окисление (отдача электронов), на катоде – восстановление (присоединение электронов).
Электродные процессы:
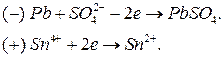
Схема гальванического элемента:
 .
.
Пример 5. Рассчитайте теоретически возможное количество электричества, энергии, удельной энергии на единицу массы (Fe и NiOOH), Вт×ч/г, которые можно получить в никель-железном аккумуляторе, работающем при стандартных состояниях веществ, температуре 298 К, если ЭДС его составляет 1,48 В, исходная масса железного электрода 55,85 г, а масса NiOOH эквивалентна массе железного электрода.
Решение.
Теоретически возможное количество электричества Q (емкость) определяется объединенным законом Фарадея (10):
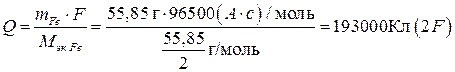 .
.
Энергия аккумулятора W рассчитывается по уравнению (13):
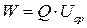 ,
,
где 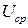 - среднее напряжение разряда.
- среднее напряжение разряда.
Теоретическое максимальное количество энергии W, которое можно получить в аккумуляторе, найдем по уравнению (14):
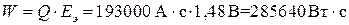 .
.
Удельную энергию 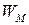 рассчитаем по уравнению (15):
рассчитаем по уравнению (15):
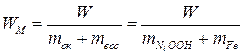 .
.
Массу NiOOH определяем по закону эквивалентов:
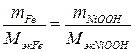 .
.
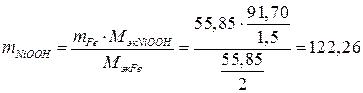 (г).
(г).
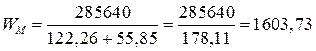 (Вт×с/г).
(Вт×с/г).
Пример 6. Рассчитайте ЭДС свинцового аккумулятора при 298 К и активностях ионов 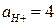 моль/л;
моль/л; 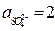 моль/л; активности воды
моль/л; активности воды 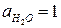 моль/л.
моль/л.
Решение.
При работе свинцового аккумулятора протекают процессы:
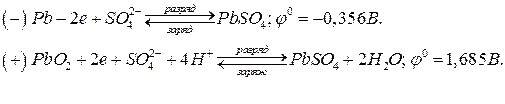
Суммарная электрохимическая реакция, протекающая в свинцовом аккумуляторе:
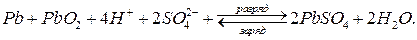
При разряде аккумулятор работает как гальванический элемент, ЭДС которого (Еэ) можно рассчитать по формуле (8а):
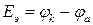 .
.
Потенциалы электродов рассчитываются с помощью уравнения Нернста (7):

Пример 7. Рассчитайте стандартную ЭДС топливного элемента, в котором при 298 К протекает электрохимическая реакция:
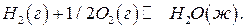
Используя термодинамические данные, вычислите константу равновесия этой реакции.
Решение.
Стандартная ЭДС, соответствующая относительным парциальным давлениям газов 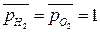 и активности воды
и активности воды 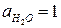 , может быть рассчитана по уравнению (18б):
, может быть рассчитана по уравнению (18б):
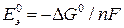 .
.
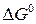 рассчитывается по уравнению (19). Количество переданных электронов в элементарном процессе определяются, исходя из реакций, протекающих в водородно-кислородном ТЭ:
рассчитывается по уравнению (19). Количество переданных электронов в элементарном процессе определяются, исходя из реакций, протекающих в водородно-кислородном ТЭ:
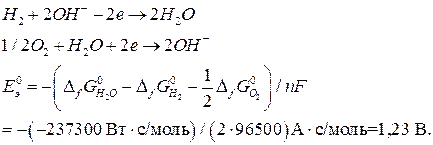
Константу равновесия рассчитываем по уравнению (23):
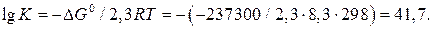
Откуда 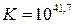 .
.
Пример 8. Габариты серебряно-цинкового аккумулятора типа СЦ-50 равны 64х49х165 мм, масса m =0,84 кг. При разряде током 5,0 А аккумулятор проработал t =12 ч 20 мин, из них1 ч 25 мин ( 12 ч 25 мин) при напряжении
12 ч 25 мин) при напряжении 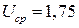 В, в остальное время
В, в остальное время 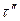 при
при 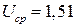 В. Каковы удельные характеристики аккумулятора?
В. Каковы удельные характеристики аккумулятора?
Решение.
1. Разрядная емкость аккумулятора (9): 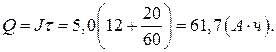
2. Отданная энергия (13):
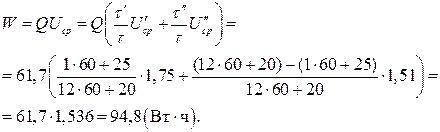
3. Объем аккумулятора: 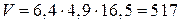 (см3) = 0,517 л.
(см3) = 0,517 л.
4. Удельная емкость
по массе 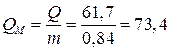 (А×ч/кг);
(А×ч/кг);
по объему 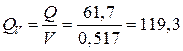 (А×ч/л).
(А×ч/л).
5. Удельная энергия
по массе 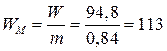 (Вт×ч/кг);
(Вт×ч/кг);
по объему 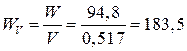 (Вт×ч/л).
(Вт×ч/л).
Пример 9. Емкость свежезаряженного щелочного никель-кадмиевого аккумулятора типа НК-80 равнялась 80,3 А×ч. После двухмесячного бездействия в заряженном состоянии емкость того же аккумулятора составила 53,4 А×ч. Определите саморязряд аккумулятора за месяц.
Решение.
Саморазряд аккумулятора рассчитываем по формуле (17):
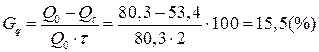 .
.
4. КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. Направления электрохимической энергетики
2. Классификация химических источников тока (ХИТ).
3. Принцип действия гальванического элемента (ГЭ) – первичного химического источника тока (ХИТ).
4. Электрохимические характеристики гальванического элемента (ГЭ).
5. Существующие первичные химические источника тока (ХИТ).
6. Перспективные первичные химические источники тока (ХИТ).
7. Цинковые гальванические элементы (ГЭ).
8. Магниевые гальванические элементы (ГЭ).
9. Литиевые гальванические элементы (ГЭ).
10. Коммуникация химических источников тока (ХИТ).
11. Электродные и токообразующие реакции в первичных химических источниках тока (ХИТ).
12. Классификация вторичных химических источников тока (ХИТ) – аккумуляторов.
13. Кислотные аккумуляторы.
14. Щелочные аккумуляторы.
15. Аккумуляторы с твердым и расплавленным электролитом.
16. Принцип действия вторичных химических источников тока (ХИТ) – аккумуляторов.
17. Электрохимические характеристики аккумуляторов.
18. Процессы при эксплуатации вторичных химических источников тока (ХИТ) – аккумуляторов.
19. Литиевые аккумуляторы.
20. Никелевые, цинковые аккумуляторы.
21. Свинцовые аккумуляторы.
22. Металловоздушные аккумуляторы, с неводными растворами, с твердыми электролитами, высокотемпературные, редокс-аккумуляторы.
23. Понятие топливного элемента (ТЭ). Классификация топливных элементов.
24. Примеры электрохимических систем, разработанных для топливных элементов.
25. Характеристика окислителей и восстановителей, применяемых в топливных элементах.
26. Виды электрохимических конденсаторов.
27. Наноматериалы в энергетике.
28. Нанотехнологии в энергетике.
29. Химические источники тока для электромобиля.
30. Электрохимические энергоустановки (ЭЭУ) и электрохимические электростанции (ЭЭС).
31. Составьте таблицу электродных потенциалов алюминия в растворах с активными концентрациями 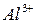 : 1; 0,1; 0,01; 0,0001; 0,00001 моль/л и начертите кривую зависимости электродного потенциала от концентрации ионов.
: 1; 0,1; 0,01; 0,0001; 0,00001 моль/л и начертите кривую зависимости электродного потенциала от концентрации ионов.
32. Вычислите, как изменится электродный потенциал цинкового электрода, если концентрация раствора сульфата цинка, в который погружена цинковая пластинка, уменьшится от 0,1 до 0,01 н (активность частиц a примите равной концентрации с).
33. Вычислите ЭДС гальванического элемента
