Министерство образования Республики Беларусь
Учреждение образования
«Международный государственный экологический институт имени А. Д. Сахарова»
Белорусского государственного университета.
Факультет экологической медицины
Контрольная работа №2
Тема: «Требования к ограничению облучения населения. Ограничение техногенного облучения в нормальных условиях.»
По дисциплине: «Молекулярная и клеточная радиобиология с основами радиационной гигиены»
Студента 4 курса ФЭМ группы 43072
Каранчуковой Аллы Олеговны
Номер зачетной книжки 43071-24
Преподователь:
Старший преподаватель кафедры
Экологической медицины
И радиобиологии
_________И.В.Пухтеева
Роль белка р53 как «стража генома» в клетке и в реализации апоптоза.
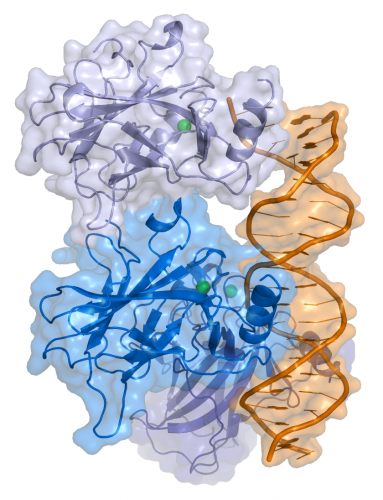
Белок p53 — это транскрипционный фактор, регулирующий клеточный цикл. Ген человека, кодирующий белок p53, называется TP53. Этот ген расположен на хромосоме 17 (17p13.1).
Структура р53
Человеческий белок p53 состоит из 393 аминокислотных остатков и имеет 5 доменов:
— В N-концевой области находится многокомпонентный трансактивационный (ТА) домен(1-73 а.к.)
— Богатый пролиномSH 3 домен (63-97 а.к.)
— ДНК-связывающий домен (94-312 а.к.)
— Домен, отвечающий за образование полимера белка (олигомеризацию), 325-355 а.к.
— C-концевой домен, играющий важную роль в регуляции активности белка.
— (360-393 а.к.)
ФУНКЦИИ P53
P53 ОБЕСПЕЧИВАЕТ АЛЬТРУИСТИЧЕСКОЕ ПОВЕДЕНИЕ КЛЕТОК МНОГОКЛЕТОЧНОГО ОРГАНИЗМА
Благодаря активности р53 клеткам многоклеточного организма свойственно альтруистическое поведение, при котором ослабленные и поврежденные клетки сами жертвуют собой, не вступая в конкурентные взаимоотношения с окружающими более здоровыми клетками. В результате строгого соблюдения запрета на конкуренцию между клетками становится невозможным генетический отбор, который позволил бы выживать и давать потомство наиболее приспособленным к тому или иному условию мутантным вариантам клеток. Функция р53, таким образом, обеспечивает генетическую стабильность, генетическую однородность соматических клеток.
Белковая молекула р53 имеет характерное для транскрипционного фактора строение и состоит из доменов, определяющих способность к узнаванию и связыванию со специфическими последовательностями
ДНК, а также к взаимодействию с компонентами транскрипционной
машины и ее активации. Связываясь с регуляторными участками
определенных генов, р53 обычно вызывает их активацию, хотя некоторые гены он, напротив, репрессирует, используя для репрессии
несколько альтернативных механизмов. Описано несколько транскрипционно-независимых функций р53 (например, способность транслоцироваться в митохондрии и оказывать про-апоптозное действие, способность непосредственно участвовать в репарации повреждений ДНК), функциональная направленность которых также хорошо соответствует стратегии р53 на обеспечение генетической стабильности.
При превышении физиологически допустимого уровня повреждений
задачей р53 становится избавление от генетически опасных дефектных клеток, что достигается либо путем активации апоптоза, либо за счет терминального выхода клеток из процесса деления, что является формой генетической смерти.
РЕГУЛЯЦИЯ АКТИВНОСТИ P53
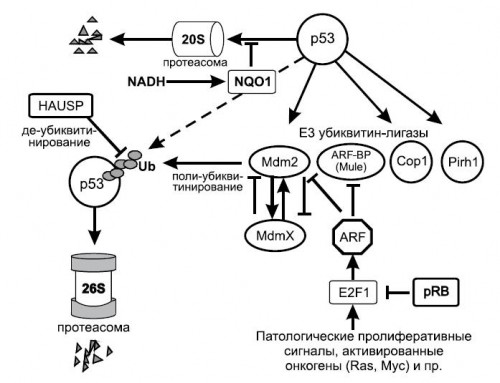
Инициаторами разрушения р53 в системе 26S протеасомслужат несколько убиквитиновыхлигазтипа Е3. Наиболее изученной среди них является убиквитиноваялигаза Mdm2, которая сама является продуктом гена, активируемого р53 (Hauptetal., 1997). В результате, повышение активности р53 приводит к индукции Mdm2, и, соответственно, к усилению разрушения р53 в 26S протеасомах. Недавно установлено участие других убиквитин-лигаз типа Е3 (Cop1, Pirh2, ARF-BP/MULE, CHIP) в регуляции уровней р53, причем две из них (Cop1 и Pirh2), подобно белку Mdm2, выступают в качестве транскрипционных мишеней и, таким образом, вместе с р53 образуют обратные регуляторные связи.
Разрушение р53 может осуществляться также по убиквитин независимому пути, в 20S протеасомах (Asher, G., Shaul, Y., 2005). Этот путь быстрого разрушения характерен для белков, имеющих выраженные неструктурированные участки, в частности, он реализуется при разрушении денатурированных белков. Белковая молекула р53 имеет неструктурированные участки в N- и С-концевых областях, что обуславливает ее разрушение в 20S протеасомах.
Важным компонентом регуляции активности Mdm2 служит близкородственный белок MdmX, который имеет очень сходное строение, но в отличие от Mdm2 не обладает Е3 убиквитин-лигазной активностью (Jackson, M.W., Berberich, S.J., 2000). Белок MdmX связывается с N-концевой областью р53, подавляет его транскрипционную активность, но не вызывает его разрушения. Он также способен гетеро-олигомеризоваться с Mdm2 (Sharpetal., 1999), что с одной стороны, приводит к стабилизации Mdm2, а с другой - к ускорению разрушения MdmX. Таким образом, изменения соотношений этих двух белков может тонко регулировать количество и активность р53.
Установлено, что белок HAUSP, один из таких ферментов, удаляет убиквитин с белка Mdm2 (Li, M. etal., 2004), в то время как другой белок, Daxx, образует комплекс с Mdm2 и HAUSP и предотвращает самоубиквитинирование Mdm2, вызывая его стабилизацию, чем способствует ускорению разрушения р53. В то же время, HAUSP может удалять убиквитин и с самого р53, приводя к его стабилизации.
Важным регулятором Mdm2-зависимого разрушения р53 выступает белок ARF - продукт альтернативной рамки трансляции гена CDKN2A, который также кодирует ингибиторциклин-зависимой киназы, белок р16. ARF представляет собой аномально щелочной белок, на 20% состоящий из аргинина, но не содержащий лизина. ARF обладает свойствами опухолевого супрессора, и его отсутствие приводит к фенотипу, напоминающему отсутствие р53.Связываясь с Mdm2 ARF подавляет его убиквитин-лигазную активность и вызывает активацию р53 (Kamijoetal., 1998). Накапливающийся белок ARF блокирует Mdm2 и тем индуцирует р53, повышая чувствительность клеток к апоптозу. ARF блокирует и другую Е3 лигазу ARF-BP (или MULE), которая также принимает участие в разрушении р53. Однако, кроме р53, субстратами для Е3 лигазы ARF-BP служат и некоторые другие белки, например про-апоптозный белок Mcl1.
Отдельное место занимает связывание р53 с белками ASPP1 и ASPP2 (Bergamaschietal., 2004) и их антагонистом iASPP, которые регулируют специфичность связывания р53 с регуляторными элементами определенных функциональных групп генов, что приводит к изменениям реакции клеток на индукцию р53 - либо в сторону повышения выживаемости, либо в сторону индукции клеточной смерти.
ДОМЕННАЯ СТРУКТУРА БЕЛКА P53
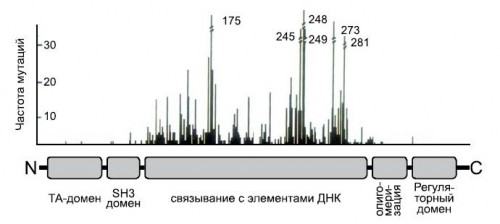
Активная молекула р53 представляет собой тетрамер (Jeffreyetal., 1995). Мономер р53 имеет выраженную доменную организацию. В N-концевой области (1-73 а.к.) находится многокомпонентный трансактивационный (ТА) домен и примыкающий к нему (63-97 а.к.) богатый пролином SH3 домен. Центральную треть белковой молекулы (94-312 а.к.) занимает участок, ответственный за узнавание и связывание специфических элементов ДНК. На эту область приходится большинство точечных мутаций гена р53. Ближе к С концу располагается олигомеризационный домен (325-355 а.к.) и неструктурированный щелочной С-концевой домен (360-393), играющий важную роль в регуляции активности белка (Laptenko, O., Prives, C., 2006).
ПЕРЕДАЧА СИГНАЛОВ НА P53
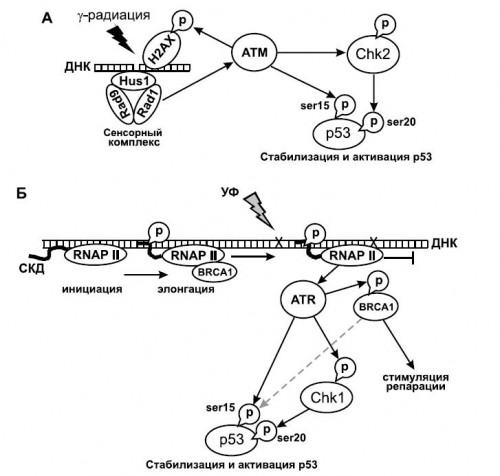
Описан целый ряд состояний, в которых активируется р53. К ним относится истощение запасов нуклеотидов, нарушения цитоскелета(нарушения полимеризации актиновых волокон, деполимеризация микротрубочек), нарушения биогенеза рибосом, состояние гипоксии и ишемии, состояние гипероксии, отсутствие или избыток некоторых ростовых факторов или цитокинов, нарушения клеточной адгезии и фокальных контактов, дефектные интегрины, нарушение прикрепления клеток к субстрату, появление полиплоидных клеток, образование микроядер, разрушение хромосомного веретена, гипер- и гипотермия, действие окиси азота (NO) и многое другое.
В настоящее время наиболее изученным является процесс индукции
р53 при повреждениях ДНК. В качестве примера механизма индукции р53 можно рассмотреть состояния, вызванные действием двух типов излучения - гамма радиации и ультрафиолета. Если в первом случае происходит более или менее <чистое> повреждение, с образованием разрыва цепи ДНК, то во втором наблюдаются сшивки ДНК, вызванные димерами тимина.
Киназа АТМ может напрямую активировать р53, фосфорилируя его по Ser15 (Sarkariaetal., 1999). Среди прочих мишеней киназаАТМфосфорилирует и активирует киназу сверочных точек Chk2, которая, в свою очередь, фосфорилирует р53 по Ser20, вызывая его активацию.
Подавление продвижения РНК-полимеразы II с помощью ингибиторов транскрипции, на стадии элонгации, при которой C-концевой домен полимеразы полностью фосфорилирован, приводит к активации р53, причем накапливающийся белок р53 фосфорилирован по Ser15 и Lys382 (Ljungmanetal., 2001). По видимому, похожая ситуация складывается и при остановке элонгации под действием препятствий на пути полимеразы, вызванных повреждениями ДНК. В обоих случаях происходит активация киназы АТR. Киназа ATR, подобно киназеАТМ может фосфорилировать напрямую р53 по Ser15, но кроме этого активирует киназу сверочной точки Chk1, которая, подобно киназе Chk2, фосфорилирует р53 по Ser20. Другой механизм распознавания застреваний полимеразы на матрице включает белок BRCA1, который при элонгации ассоциирован с РНК-полимеразой II. При остановке транскрипции происходит фосфорилирование BRCA1 и его удаление из транскрипционного комплекса.
Одним из сенсоров может выступать сам белок р53, поскольку он обладает способностью узнавать и связываться с поврежденными участками ДНК (Lee, S. etal., 1997). За счет своего С-концевого домена р53 не только может связываться с такими участками, но также выполняет функцию репарационного фермента. Белок р53 обладает активностью 3'-5' экзонуклеазы, и может вырезать поврежденные участки, которые затем могут достраиваться другими ферментами репарации.
Передача сигналов на р53
— Процесс индукции
р53 при действии двух типов излучения - гамма радиации и ультрафиолета.
— Киназа АТМ может напрямую активировать р53.
— КиназаАТМ активирует киназу сверочных точек Chk2, которая, в свою очередь, активирует р53.
— Подавление продвижения РНК-полимеразы II приводит к активации р53.
— В обоих случаях происходит активация киназы АТR.
— Другой механизм распознавания застреваний полимеразы на матрице включает белок BRCA1, который при элонгации ассоциирован с РНК-полимеразой II.
— При остановке транскрипции происходит фосфорилирование BRCA1 и его удаление из транскрипционного комплекса.
ГЕНЫ, УЧАСТВУЮЩИЕ В ИНДУКЦИИ КЛЕТОЧНОЙ СМЕРТИ
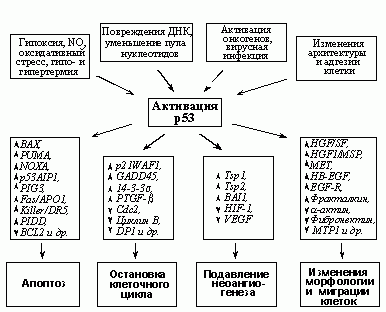
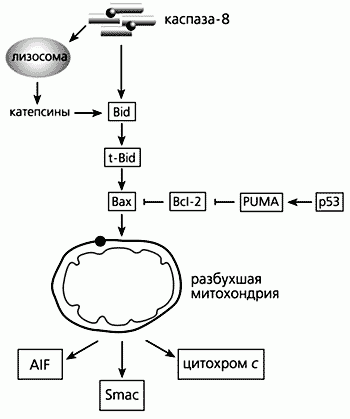
Пожалуй, это самая многочисленная из известных групп р53 индуцируемых генов. Апоптоз представляет собой форму программированной клеточной смерти, осуществляемой через действие цистеиновыхпротеиназ каспаз. Эффекторныекаспазы 2, 3, 7 осуществляют основной демонтаж клеточных структур. Они активируются под действием инициаторныхкаспаз 8 и 9. Запуск инициаторныхкаспаз осуществляется по активацию <рецепторов смерти>, реагирующих с определенными внеклеточными лигандами, что сопровождается сборкой протеазных комплексов, активирующих инициаторнуюкаспазу 8.
Второй - митохондриальной путь, когда стимулом служит освобождаемый из митохондрий цитохром С, который активирует белок Apaf1, осуществляющий активирующий протеолиз инициаторнойкаспазы 9. Регуляция проницаемости митохондриальной мембраны осуществляется за счет баланса взаимодействующих белков семейства Bcl2, среди которых одни действуют в сторону понижения проницаемости митохондриальной мембраны (анти-апоптозные белки), а другие, про-апоптозные белки, наоборот, стимулируют выброс цитохром С. Белок р53 влияет как на внешний, так и на митохондриальный пути индукции апоптоза (Vousden, K.H., Lu, X., 2002).
Действуя на митохондриальный путь, р53 репрессирует транскрипцию анти-апоптозного белка Bcl2 и активирует транскрипцию про-апоптозных белков Bax, Noxa, p53AIP1 и Puma. Кроме того, р53 активирует транскрипцию гена APAF1, повышает чувствительность клеток к внешним про-апоптознымлигандам, стимулируя транскрипцию генов FAS (APO1) и KILLER/DR5. Белок р53 индуцирует также множество других белков, связанных с индукцией апоптоза. Существует также значительная группа р53-индуцируемых генов, функция которых связана с изменением редокс баланса клетки. Согласно одной из моделей, резкое повышение уровня внутриклеточных кислородных радикалов, происходящее при индукции данной группы генов может способствовать ускорению клеточной смерти.
Недавно появились сообщения о принципиально новой стратегии р53 в отношении индукции клеточной смерти, которая включает транскрипционную активацию гена, кодирующего микроРНК. МикроРНК представляют собой короткие шпилечные нетранслируемые РНК, которые взаимодействуют с определенными мРНК, к которым они имеют сродство, вызывая подавление их функции. Активируемая р53 микроРНК miR34 также способна влиять на экспрессию ряда генов, хотя точные мишени ее пока неясны. Само по себе введение конструкций, экспресирующих miR34 вызывает остановку делений и апоптоз.
В процессе трансформации под действием онкогена Ras наблюдается значительное повышение уровня кислородных радикалов. Это повышение приводит к индукции р53, что сопровождается апоптозом или необратимой задержкой клеточного деления. В случае поломок р53-зависимых механизмов ограничение роста клеток, экспрессирующих онкоген Ras, не происходит, а увеличенный уровень кислородных радикалов ускоряет мутагенез, приводя к дальнейшему развитию опухолевого процесса (Kopninetal., 2007). Таким образом, антиоксидантная активность р53 является важной составляющей его функции, направленной на предотвращение развития опухолей.
МИТОХОНДРИАЛЬНАЯ ФУНКЦИЯ P53
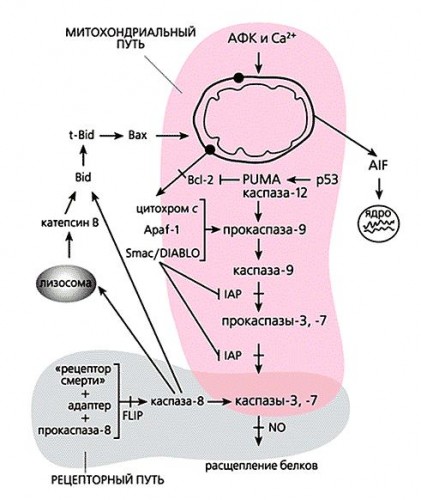
Белок р53 способен не только активировать гены, участвующие в индукции клеточной смерти за счет своей транскрипционной функции,
но и принимает непосредственное участие в индукции митохондриального пути клеточной смерти (Ersteretal., 2004). После активации р53 под действием всевозможных стрессов часть р53 поступает в митохондрии, где он вступает во взаимодействие с анти- и про-апоптозными белками Bcl семейства (BclXL/Bcl2 и Bak, соответственно). Эти взаимодействия приводят к нарушению проницаемости наружной митохондриальной мембраны, утечке цитохрома С и индукции апоптоза.
Поступление р53 в митохондрии регулируется за счет убиквитинирования: его полиубиквитинированные формы поступают в 26S протеасомы, где подвергаются разрушению, а моноубиквитинированные - идут в митохондрии. В митохондрии р53 поступает из цитоплазмы, минуя вхождение в ядро. Под влиянием стрессов стабилизированный р53 поступает либо в ядро, где участвует в транскрипционной регуляции, либо сразу в митохондрии. Белок Mdm2 сам по себе не участвует в транспорте р53 в митохондрии, но его фоновая активность обеспечивает моноубиквитинирование, необходимое для транслокации в митохондрии. Возможно также участие других Е3 лигаз в моноубиквитинировании р53. В митохондриях р53 подвергается быстрому ферментативному деубиквитинированию под действием митохондриального HAUSP и превращению в активную форму.р53 вступает во взаимодействие с BH4 доменом анти-апоптозных белков BclXL и Bcl2, причем взаимодействующий участок р53 соответствует ДНК-связывающему домену. Связывание с анти-апоптозными белками высвобождает и активирует про-апоптозные
белки Bax и Bid. Активация белка Bax под действием цитоплазматического р53 происходит за счет перестройки конформации и олигомеризации, что способствует перемещению цитозольногоBax в митохондрии. Кроме того, связываясь в митохондриях с белком Bak белок р53 непосредственно стимулирует его олигомеризацию и активацию, а также вытесняет его из комплекса с анти-апоптозным белком Mcl-1 (Leu, J.I. etal., 2004). Все эти взаимодействия вызывают выброс цитохрома С и индукцию апоптоза даже без транскрипционной активации про-апоптозных генов-мишеней р53.
Интересно, что полиморфный вариант р53 Arg72 обладает значительно большей способностью к митохондриальнойтранслокации по сравнению с Pro72 р53, и это коррелирует с различиями их про-апоптозной активности (Dumontetal., 2003). Прямая индукция апоптоза под действием р53, по-видимому, является первой и очень быстрой реакцией на массивные повреждения. Вторая волна индукции апоптоза отмечается только через 6-7 часов, и она связана с транскрипционной активностью р53 в ядре. Присутствие р53 в цитоплазме сенсибилизирует клетки к продуктам р53-регулируемых генов PUMA и NOXA. Белок Puma очень эффективно вытесняет р53 из комплекса с BclXL, и освободившийся р53 активирует про-апоптозную функцию белка Bax. Кроме того, более активный белок Puma вытесняет из комплексов с BclXL менее активные про-апоптозные белки Bim и Bid, что повышает эффективность индукции апоптоза. Таким образом, действуя сразу на нескольких уровнях и путем использования совершенно разных механизмов, р53 осуществляет как быстрые реакции на сильные стрессы, так и реализует замедленную, но очень эффективную программу апоптоза поврежденных клеток.
P53 И СТАРЕНИЕ
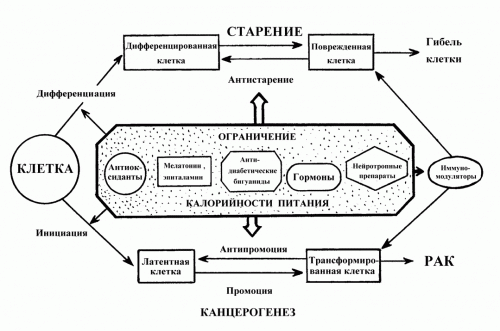
Будучи центром контроля правильности выполнения генетических программ, р53 неминуемо должен иметь отношения и к процессам
старения организма. До сих пор неясно, является ли процесс старения организма непосредственно запрограммированным процессом, или он ускоряется после прекращения действия программ регенерации и репарации организма по достижении определенного возраста. Известны значительные отклонения в продолжительности жизни организмов в пределах одного вида, причем имеются веские аргументы в пользу наследуемости признака долголетия. Поэтому наследственность можно рассматривать как первый из факторов, определяющих продолжительность жизни. Вторым фактором, безусловно, является образ жизни, поскольку существует множество указаний влияния образа жизни на ее продолжительность (Deppetal., 2007). Наиболее обоснованным и достоверным представляется вывод о роли ограничения калорийности питания в увеличении продолжительности жизни (Guarente, L., 2005). Достаточно аргументированным является также представление о роли окислительных процессов в развитии процессов старения.
Существующие в настоящее время представления о роли р53 в старении весьма противоречивы. Генетические манипуляции с геном р53 на мышах дают весьма неоднозначные результаты. Изучение старения на модели мышей, лишенных р53 невозможно, поскольку эти мыши не доживают до одного года, погибая от злокачественных лимфом. Пересадка мышам частично активированного гена р53 приводит к существенному уменьшению частоты спонтанных опухолей, однако при этом наблюдается феномен преждевременного старения. В то же время, введение в геном мышей дополнительной копии немодифицированного гена р53 (Garcia-Caoetal., 2002), или снижение экспрессии гена Mdm2 (Mendrysaetal., 2006) приводит к защите от развития рака без снижения продолжительности жизни.
У людей распространен полиморфизм гена р53 по 72-й аминокислоте. Аллель Arg72, в отличие от Pro72, отличается лучшей защитой против рака, так как с этой аллелью связана митохондриальнаянетранскрипционная функция р53. Люди гомозиготные по аллели Pro72 обладают пониженной противораковой защитой, чаще страдают онкологическими заболеваниями по сравнению с гомозиготными носителями аллели Arg72, но в то же время характеризуются большей средней продолжительностью жизни. Эти результаты указывают на то, что противораковая защита имеет обратную сторону - ускорение процессов старения (Campisi, J., 2003).
Каким же образом можно объяснить этот парадокс и существуют ли способы преодоления негативного действия р53? Для того чтобы найти ответ на этот вопрос надо вспомнить, что определяет проявление двух противоположных свойств р53. Низкие уровни р53 способствуют
оптимальной сбалансированности процессов, снижению риска возникновения мутаций и повышению скорости процессов репарации.
Очевидно, что это свойство р53 благоприятно как в плане профилактики рака, так и в замедлении процессов старения. Продление жизни организмов путем ограничения потребления калорий, вероятно, также не обходится без участия р53, поскольку при физиологически допустимом уровне р53 тормозится модуль IGFmTOR, а дефицит глюкозы способствует адаптивному повышению активности р53, посредством стимуляции АМР-зависимой киназы AMPK. Полезную роль может играть также активация аутофагии, в частности, с участием контролируемого р53 гена DRAM. В процессе аутофагии происходит омоложение цитоплазмы клеток. Это осуществляется за счет переваривания в лизосомах накапливающихся в цитоплазме поврежденных белков, характерных для стареющих клеток (например липофуксина), а также за счет преимущественного удаления поврежденных митохондрий, выделяющих повышенные количества кислородных радикалов (Termanetal., 2007). При низком уровне р53 его антиоксидантная функция дополнительно снижает риск накопления мутаций. Она оберегает организм от преждевременной выработки ресурса, поскольку постоянно высокий уровень кислородных радикалов приводит к ускоренной эрозии теломер, которые при каждом делении укорачиваются протяженными блоками (Saretzki, G., VonZglinicki, T., 2002). Таким образом, при умеренном образе жизни активность гена р53 направлена как против риска возникновения рака, так и против преждевременного старения.
Другое проявление активности р53 связано с вынужденными радикальными мерами, к которым организму приходится прибегать при серьезных стрессах, интоксикациях, облучении, инфекциях и воспалениях, перегрузке организма калориями, нарушениях метаболизма вследствие болезней (например, диабете), злоупотреблении лекарственными средствами. Все эти воздействия могут приводить к качественно иному уровню активации р53, что приводит к апоптозу наиболее поврежденных клеток. Апоптоз сопровождается массивным выбросом кислородных радикалов, которые действуют не только на апоптозные клетки, но и оказывают действие на все микроокружение. Это создает условия для окисления ДНК, возникновения мутаций, изменения внеклеточного матрикса, с последующим накоплением поврежденных белков, развитием тканевых
патологий, гибелью клеток паренхимы органов, развитие фиброза и.т.п.
Хронические воспаления вызывают перманентный окислительный стресс в пораженных тканях, способствуя ускоренной эрозии теломер и локальной выработки ресурса регенерации ткани. Это может приводить к<локальнымпрогериям>, то есть к локальному старению тканей, что лежит, например, в основе ряда нейродегенеративных заболеваний, а также способствует развитию легочной эмфиземы, патологии почек и т.д. В патогенезе всех этих состояний самую активную роль играет р53. Таким образом, функция р53 не только обеспечивает пресечение <неправильного поведения> клеток, но и решает судьбу людей в случае их неразумного обращения со своим здоровьем. Знание механизмов действия р53 еще раз убеждает в неоспоримом преимуществе профилактического подхода к борьбе с болезнями. В основе здоровья и долголетия лежит умеренность, и тогда р53 действительно становится нашим <Ангелом Хранителем>.
ЗАКЛЮЧЕНИЕ
Было установлено, что белковой молекуле р53 свойственны несколько независимых по природе активностей. Несмотря на разнообразие активностей белка р53, каждая из них вносит вклад в обеспечение единой макрофункции - поддержания генетической идентичности клеток многоклеточного организма. Функция белка р53 обуславливает альтруистическое поведение клеток, при котором поврежденные и неполноценные клетки самостоятельно принимают решение о своей гибели. Через многочисленные связи на р53 сходятся сигналы об
отклонениях от оптимума процессов, а также о наличии структурных
повреждений, что, в зависимости от степени отклонения, приводит
либо к ускорению процессов репарации и защиты, либо к остановке
клеточных делений или апоптозу. Утрата функции гена р53 наблюдается практически в каждом случае злокачественных заболеваний, а его недостаточность неминуемо приводит к развитию опухолей. Понимание функции белка р53 позволяет разрабатывать не только новые подходы к лечению онкологических заболеваний, но и определять стратегию профилактики множества болезней, включая меры по замедлению процессов старения.
Список использованных источников
1.Баюров Л.И. РАДИОБИОЛОГИЯ Учебное пособие Краснодар 2008. 50 с.
2. Основы радиобиологии. Учебное пособие для специальностей высшего профессионального образования группы «Здравоохранение» / Сост. А.Д. Доника, С.В. Поройский.-Волгоград: Изд-во ВолгГМУ, 2012. - 136с.
3. Практическое пособие по общей радиобиологии для студентов медико- биологического факультета: Учебно-методическое пособие / Сост.: Л.Н. Рогова, Е.И. Губанова, Р.К. Агаева и др. Под ред. Проф. Л.Н. Роговой. - Волгоград: Изд-во ВолГМУ, 2010. - 124 с
4. Для подготовки данной работы были использованы материалы с сайта https://ru.wikipedia.org/wiki/P53