Радиус атома, энергия ионизации, электроотрицательность, их периодические изменения
Атомы характеризуются несколькими важными для химии свойствами, которые изменяются периодически. Рассмотрим некоторые из этих свойств.
Одной из главных характеристик атома является его размер (радиус). От размеров атомов зависит их размещение в кристаллических структурах и молекулах, способность терять и принимать электроны давать разные типы химических связей. Атом не может иметь ограничивающей поверхности, подобной поверхности твердого шарика или капли жидкости. Его граница расплывчата, она определяется характером движения самых внешних электронов атома.
Закономерность изменения радиуса в периоде по мере увеличения атомного номера можно выяснить, начиная с лития, т. к. в 1-м периоде всего два элемента. При переходе от лития к бериллию ⟶ бору ⟶ углероду ⟶ азоту ⟶ кислороду ⟶ фтору ⟶ неону радиусы атомов постепенно уменьшаются. Это вызвано усилением притяжения электронов к ядрам атомов с увеличивающимся зарядом. В то же время увеличение числа электронов на данном энергетическом уровне ведет к возрастанию их взаимного отталкивания, потому к концу периода уменьшение радиуса замедляется.
При переходе от неона к натрию – 1-му элементу 3-го периода – радиус снова резко возрастает, а потом постепенно уменьшается до аргона. После этого снова происходит резкое увеличение радиуса у калия. Получается характерная периодическая пилообразная кривая.
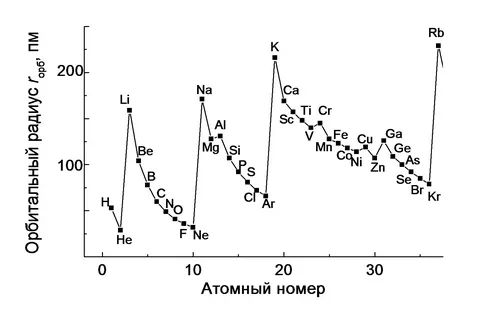
Каждый участок кривой от щелочного металла до благородного газа характеризуется изменение радиуса в периоде: наблюдается уменьшение радиуса при переходе слева на право.
В группах химических элементов также происходит изменения радиуса атома. Если провести линию через элементы одной группы (см. рис.), то по положению максимумов, например, у щелочных металлов видно, что радиусы атомов при переходе в группе сверху вниз увеличиваются. Это связано с увеличением числа электронных оболочек.
От радиусов зависят многие другие свойства атомов, как физические, так и химические. Например, увеличением радиусов можно объяснить понижение температуры плавления щелочных металлов от лития к цезию:
Li Na K Rb Cs
r, пм 159 171 216 229 282
t, ⁰C 180 98 63 39 28
Размеры атомов связаны с их энергетическими свойствами: чем дальше от ядра находится движущийся электрон, тем легче отнять этот электрон от атома. При этом атом превращается в положительно заряженный ион.
Ион - одно из возможных состояний атома, в котором он имеет электрический заряд вследствие потери собственных или присоединения дополнительных электронов.
Способность атома терять электрон характеризуется энергией ионизации – это минимальная энергия, необходимая для отрыва внешнего электрона от атома в газовом состоянии.
Энергия ионизации атомов увеличивается в периоде при переходе слева на право и уменьшается в группах при переходе сверху вниз.
Еще одним из свойств атома является электроотрицательность – это способность атома притягивать к себе электроны.
Электроотрицательность атомов находится в той же периодической зависимости от порядкового номера элемента, как энергия ионизации: увеличивается в периоде слева на право и уменьшается в группе сверху вниз.
Причины изменения металлических и неметаллических свойств атомов
В каждом периоде системы химических элементов слева на право происходит последовательное увеличение зарядов атомов, что обуславливает усиление притяжения электронов к ядру, сжатие электронных облаков и уменьшение радиуса атомов. В связи с этим наименьшей прочностью связи электронов внешнего слоя с ядром характеризуются атомы элементов, находящихся в начале периодов. Таким образом, атомы именно этих элементов наиболее легко отдают электроны. Способность атомов элементов отдавать электроны называется металличностью.
Атомы электронов, находящихся в конце каждого периода, обладают большим сродством к электрону, т. е стремлением к присоединению «чужих» электронов, результатом чего является образование завершенного внешнего электронного слоя (электронного октета). Способность атомов элементов присоединять электроны называется не металличностью.
Все элементы можно разделить на металлы и неметаллы. Металлы – это элементы, атомы которых более или менее легко отдают электроны и практически не обладают способностью присоединять электроны. При отдаче электронов атомы металлов превращаются в положительно заряженные ионы – катионы. Типичные неметаллы – это элементы, для атомов которых характерна способность к присоединению электронов с образованием отрицательно заряженных ионов – анионов.
Итак, в периодах слева на право металлические свойства элементов ослабевают, а неметаллические – усиливаются.
Например, в 3-м периоде самым активным металлом является натрий. Металлами являются также магний и алюминий, но их активность меньше. Остальные элементы периода относятся к неметаллам, среди которых самый активный – хлор. Последним элементом периода является благородный газ аргон, атомы которого имеют завершенную структуру внешнего слоя и поэтому отличаются чрезвычайной химической инертностью.
В больших периодах число элементов-металлов намного больше, чем в малых периодах. Например, в 4-м периоде первые два s-элемента являются активными металлами (K и Ge). К металлам средней активности относятся 10 d-элементов (Sc до Zn), а также два p-элемента (Ga и Ge). И только четыре элемента проявляют неметаллические свойства, которые в наибольшей степени выражены у брома.
В главных подгруппах сверху вниз число электронных слоев в атомах элементов увеличивается, что приводит к возрастанию радиусов атомов и, соответственно, к уменьшению прочности связи электронов внешнего слоя с ядром. Поэтому в главных подгруппах металличность элементов сверху в низ усиливается, а не металличность – ослабляется.
В главных подгруппах I и II групп содержатся только металлы (исключение водород), причем самым активным металлом первой группы является цезий, а второй – барий (если не рассматривать радиоактивные элементы франций и радий).
В главной подгруппе III группы самый верхний элемент – бор – проявляет неметаллические свойства, все остальные элементы являются металлами.
С продвижением по периодической системе слева на право число элементов неметаллов в главных подгруппах увеличивается (два IV в группе, три V в группе и т. д). В побочных подгруппах находятся только d-элементы, относящиеся к металлам.
Таким образом, наиболее активные металлы расположены в левой нижней части периодической системы, а наиболее активные неметаллы – в правой верхней части (диагональ бор – астат).