Спирты
Спиртами называют органические вещества, в молекулах которых углеводородный радикал связан с функциональной гидроксильной группой
-ОН. Спирты, в молекулах которых содержится одна гидроксильная группа называются одноатомными, две и более – многоатомными.
Гомологический ряд предельных одноатомных спиртов (общая формула СnH2n+1ОН):
CH 3 – OH – метиловый спирт (метанол)
CH 3 – CH 2 – OH – этиловый спирт (этанол)
CH 3 – CH 2 – CH 2 – OH – пропиловый спирт
CH 3 – CH 2 – CH 2 – CH 2 – OH – бутиловый спирт
CH 3 – CH 2 – CH 2 – CH 2 – CH 2 – OH – амиловый спирт
и т.д.
По международным правилам названия спиртов образуют от названия соответствующего предельного углеводорода с добавлением суффикса –ол, затем указываются номера атомов углерода, с которыми соединена гидроксильная группа.
СН3 – СН – СН3 СН3 – СН2 – СН2 – ОН
│ пропанол – 1
ОН
пропанол – 2
Метанол, этанол, пропанол в воде растворяются в неограниченном количестве, имеют специфический алкогольный запах Высшие спирты в воде нерастворимы.
Простейший одноатомный спирт – метиловый (метанол) СН3ОН был получен в 1834 г. путем нагревания древесных опилок и конденсации образующихся паров. Именно поэтому метиловый спирт называют д ревесным.
Метиловый спирт очень ядовит! При попадании в организм от 5 до 10 мл этого вещества человек слепнет вследствие поражения сетчатки глаз, доза в 30 мл вызывает смерть.
Этиловый спирт (этанол) С2Н5ОН – ядовитое наркотическое вещество. На этикетках виноводочной продукции есть предупреждающая надпись: «Чрезмерное употребление алкоголя вредит вашему здоровью». Однако любое даже незначительное употребление алкоголя вредит здоровью человека.
До настоящего времени для получения этилового спирта используют метод брожения сахаров под действием дрожжей:
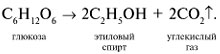
В значительно больших масштабах этиловый спирт получают гидратацией этилена:
СН2=СН2 + H2O → CH3-CH2OH
Спирт – прекрасный растворитель. Благодаря этому свойству спирт применяют в производстве лаков, красок, эмалей, используют в парфюмерной и фармацевтической промышленности. Множество экстрактов, настоек, лекарственных веществ готовят на спиртовой основе. Кроме того, этиловый спирт применяют в медицине для дезинфекции, различных компрессов и обтираний.
Спирт прекрасно заменяет бензин в качестве автомобильного топлива. По дорогам некоторых стран мира, например Бразилии, уже ездят экспериментальные автомобили, в которых в качестве топлива используется этиловый спирт. Такие машины практически не загрязняют воздух выхлопными газами.
На примере этанола рассмотрим химические свойства спиртов:
1) Спирты реагируют с активными металлами:
2С2Н5ОН + 2Na → 2C2H5ONa + H2↑
этилат нартия
2) Образование простых эфиров при избытке спирта
t=1400C
C2H5OH + HO – C2H5 → C2H5 – O – C2H5 + H2O
диэтиловый эфир
3) Горят на воздухе
С2Н5ОН + 3О2 → 2СО2↑ + 3Н2О
4) Спирты реагируют с органическими кислотами с образованием сложных эфиров. Это реакция этерификации.
О О
// H2SO4 //
СН3 – С + НО – С2Н5 ↔ СН3 – С + Н2О
\ \
ОН О - С2Н5
Этилацетат
5) Окисление спиртов в альдегид
О
//
С2Н5ОН + CuО → CH3 – C + Cu + H2O
\
H
этиловый спирт уксусный альдегид
Кроме одноатомных спиртов есть и многоатомные, например, этиленгликоль (двухатомный спирт) и глицерин (трехатомный спирт).
СН2-СН2 СН2 – СН - СН2
│ │ │ │ │
ОН ОН ОН ОН ОН
этиленгликоль глицерин
Этиленгликоль и глицерин представляют собой вязкие бесцветные жидкости, имеют сладковатый вкус, хорошо растворяются в воде. Этиленгликоль ядовит, обращаться с ним нужно очень осторожно. Водные растворы этиленгликоля применяют в качестве незамерзающей охлаждающей жидкости – антифриза, им заполняют радиаторы автотранспортной техники.
Глицерин предохраняет кожу и ткани от высыхания, его используют при выделке кож, отделке тканей, в качестве компонента косметических средств для ухода за кожей лица и рук.
Многоатомные спирты можно распознать при помощи качественной реакции со свежеосажденным гидроксидом меди (II).

Образуется раствор ярко-синего цвета.
Фенол
Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (-ОН) непосредственно связана с бензольным кольцом.
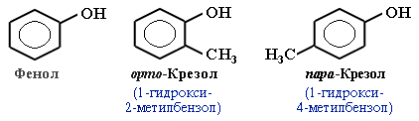
Фенол C6H5OH— бесцветное кристаллическое вещество с неприятным запахом, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66°C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, является антисептиком.
Химические свойства фенола
а) Рассмотрим реакции фенола по ОН-группе:
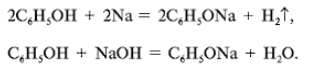
Кислотные свойства у фенола выражены сильнее, чем у спирта С2Н5ОН. Фенол – слабая кислота. В медицине фенол даже получил особое название – карболовая кислота.
б) Реакции фенола по бензольному кольцу:
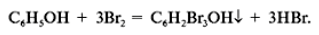
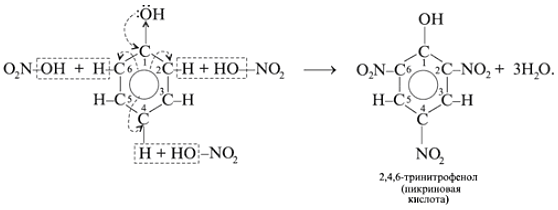
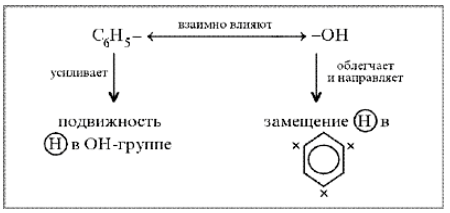
Какой вывод о взаимном влиянии атомов в молекуле фенола можно сделать?
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга.
в) Качественная реакция на фенол - при взаимодействии с FeCl3 фиолетовое окрашивание.
В промышленности фенол получают в больших количествах. Он является важнейшим сырьем для производства красителей, ядохимикатов, синтетических смол, пластмасс, лекарственных веществ, моющих средств.
Вопросы
1. Какие вещества называются спиртами?
2. Какие спирты называются одноатомными? Напишите формулы первых членов гомологического ряда предельных одноатомных спиртов, укажите их общую формулу.
3. Опишите физические и химические свойства этилового спирта, области его применения.
4. Какие спирты называются многоатомными?
5. Напишите формулы этиленгликоля и глицерина. Опишите их физические свойства и области применения.
6. Какая химическая реакция является качественной на многоатомные спирты?
7. Какие вещества называются фенолами?
8. Опишите физические, химические свойства фенола и области его применения.