Гидролиз - это протолитический процесс взаимодействия ионов солей с молекулами воды, в результате которого образуются малодиссоциирующие молекулы или ионы.
· причина гидролиза – образование слабого электролита
· способность ионов солей подвергаться гидролизу и его глубина зависят от свойств ионов, образующих соль
· малорастворимые соли из-за низкой концентрации ионов практически не гидролизуются
· для большинства солей процесс гидролиза обратим;
· гидролиз многозарядных ионов в обычных условиях преимущественно протекает по первой ступени.
В зависимости от характера иона, участвующего в процессе гидролиза, можно выделить три типа гидролиза солей. Соли, образованные сильным основанием и слабой кислотой, гидролизу не подвергаются, т.к. нет причины для гидролиза.
1. Гидролизу по катиону подвергаются соли, образованные слабым основанием и сильной кислотой.
Соль CuSO4 образована сильной кислотой H2SO4 и слабым основанием Cu(OH)2.
CuSO4 D Cu2+ + SO 
Катионы соли Cu2+ связывают ОН–- ионы воды, образуя слабый электролит (CuOH)+. В растворе появляется избыток Н+, вследствие чего раствор соли имеет кислую реакцию среды рН < 7.
Cu2+ + Н2О D (CuOH)+ + Н+
сокращенное ионное уравнение реакции гидролиза
2CuSO4 + 2Н2О D (CuOH)2SO4 + H2SO4
молекулярное уравнение реакции гидролиза
Соль NH4NO3 образована слабым основанием NH4OH и сильной кислотой HNO3.
NH4NO3  NH
NH 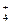 + NO
+ NO 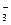
NH 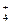 + H2O D NH4OH + H+
+ H2O D NH4OH + H+
сокращенное ионное уравнение реакции гидролиза
NH4NO3 + H2O D NH4OH + HNO3
молекулярное уравнение реакции гидролиза
Вывод: водные растворы солей, гидролизирующихся по катиону, имеют кислую реакцию среды (рН < 7). Слабым электролитом, образующимся в результате гидролиза по катиону, является основная соль (для многозарядного катиона) или слабое основание (для однозарядного катиона).
2. Гидролизу по аниону подвергаются соли, образованные слабой кислотой и сильным основанием.
Соль Na2CO3 образована сильным основанием NaOH и слабой кислотой H2СO3.
Na2CO3 D 2Na+ + CO 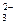
Анионы CO 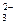 связывают ионы Н+ с образованием слабого электролита НСО
связывают ионы Н+ с образованием слабого электролита НСО 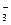 , в результате чего смещается равновесие диссоциации воды и создается избыток ОН–- ионов, обусловливающий щелочную реакцию среды (рН > 7).
, в результате чего смещается равновесие диссоциации воды и создается избыток ОН–- ионов, обусловливающий щелочную реакцию среды (рН > 7).
CO 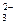 + Н2О D НСО
+ Н2О D НСО 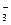 + ОН–
+ ОН–
сокращенное ионное уравнение реакции гидролиза
Na2CO3 + H2O D NaHCO3 + NaОH
молекулярное уравнение реакции гидролиза
Соль KNO2 образована слабой кислотой HNO2 и сильным основанием КОН.
KNO2 D K+ + NO 
NO  + H2O D HNO2 + OH–
+ H2O D HNO2 + OH–
сокращенное ионное уравнение реакции гидролиза
KNO2 + H2O D HNO2 + KOH
молекулярное уравнение реакции гидролиза
Вывод: водные растворы солей, гидролизирующихся по аниону, имеют щелочную реакцию среды (рН > 7). Слабым электролитом, образующимся в результате гидролиза по аниону, является кислая соль (для многозарядного аниона) или слабая кислота (для однозарядного аниона).
3. Гидролизу по катиону и аниону подвергаются соли, образованные слабым основанием и слабой кислотой.
Соль NH4CN образована анионом слабой синильной кислоты CN–, который связывает ионы Н+ из молекул воды с образованием слабой кислоты HCN, и катионом слабого основания NH 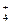 , который, связывая ионы ОН–, образует слабое основание NH4OH.
, который, связывая ионы ОН–, образует слабое основание NH4OH.
NH 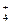 + H2O D NH4OH + H+
+ H2O D NH4OH + H+
CN– + H2O D HCN + OH–
Оба процесса усиливают друг друга за счет связывания ионов Н+ и ОН–. Реакция растворов таких солей может быть нейтральной, слабокислой или слабощелочной в зависимости от констант диссоциации образующихся кислот и оснований.
Так, при гидролизе NH4CN реакция среды будет слабощелочная, поскольку константа диссоциации NH4ОН (1,8´10–5) больше константы диссоциации HCN (8´10–10).
NH4CN + H2O D NH4OH + HCN
молекулярное уравнение реакции гидролиза
Соль CH3COONH4 образована слабой кислотой CH3COOH и слабым основанием NH4OH.
CH3COONH4 D CH3COO– + NH 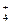
CH3COO– + H2O D CH3COOH + OH–
NH 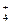 + H2O D NH4OH + H+
+ H2O D NH4OH + H+
CH3COONH4 + H2O D CH3COOH + NH4OH
Реакция среды в водном растворе соли CH3COONH4 близка к нейтральной, поскольку константы диссоциации CH3COOH и NH4OH равны 1,74´10–5 и 1,76´10–5 соответственно.