Экспериментальная часть
Восстановительные свойства металлов
Ход и данные опыта
Налейте в пробирку 2 – 4 мл раствора CuSO4 и опустите в него железную стружку. Через 1 – 2 мин достаньте стружку, промойте водой и тщательно осмотрите ее.
Как изменятся поверхности стружки? ________________________________________________
Изменился ли цвет раствора? _________________________________________________________
С чем это может быть связано? ___________________________________________
____________________________________________________________________________________________________________________________________________________________________________________
Анализ результатов опыта
1. Составьте уравнение процессов окисления и восстановления и полное молекулярное уравнение, принимая во внимание, что железо в процессе реакции окисляется до иона Fe3+.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. К какому типу ОВР относится данная реакция?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Какие функции могут выполнять в окислительно-восстановительных реакциях свободные металлы и почему? Элементарные ионы металлов и почему?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Влияние среды на характер протекания окислительно-восстановительных реакций
2.1 Окислительные свойства перманганата калия KMnO4
Ход и данные опыта
Налейте в три пробирки по 2 – 3 мл водного раствора перманганата калия. Добавьте в одну из них 3 – 4 капли 2 н. раствора серной кислоты, в другую столько же воды, в третью – 2 н. раствора щелочи. Затем внесите во все три пробирки по микрошпателю кристаллического сульфита натрия Na2SO3. Через некоторое время отметьте изменение окраски растворов во всех трех пробирках. Учтите, что фиолетовая окраска характерная для ионов MnO4-, слабо-розовая, почти бесцветная – для ионов Mn2+, зеленая – для ионов MnO42-, бурый цвет имеет осадок MnO2.
Анализ результатов опыта
1. Установите по изменению окраски, между какими веществами протекала реакция в каждом конкретном случае.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Для всех реакций, используя электронно-ионный метод, составьте частные уравнения процессов окисления и восстановления, указав окислитель и восстановитель, напишите полные молекулярные уравнения. Укажите тип ОВР.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Чем объясняется различите продуктов при взаимодействии одних и тех же веществ?
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2.2 Окислительные свойства бихромата калия K2Cr2O7
Ход и данные опыта
Налейте в пробирку 2 – 3 мл раствора бихромата калия K2Cr2O7, добавьте 3 – 4 капли серной кислоты и микрошпатель кристаллического сульфата железа FeSO4. Обратите внимание на изменение цвета раствора. Зеленая окраска характерная для иона Fe3+.
Анализ результатов опыта
1. Объясните изменение окраски раствора. Используя электронно-ионную схему процесса, укажите окислитель и восстановитель
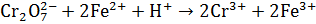
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Используя электронно-ионный метод, напишите ионно-молекулярное и молекулярное уравнения исследуемой реакции. Укажите тип ОВР.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Окислительно-восстановительная двойственность
нитрит-иона NO2-
Ход и данные опыта
Опыт проводится под тягой. Налейте в три пробирки по 2 – 3 мл нитрита натрия NaNO2. Для подкисления растворов добавьте в каждую пробирку по 3 – 4 капли 2 н. H2SO4. В первую пробирку налейте 1 – 2 мл раствора иодитого калия KI, во вторую – 1 – 2 мл перманганата калия KMnO4.
Что наблюдаете? _________________________________________________
Анализ результатов опыта
1. Чем обусловлена окислительно-восстановительная двойственность нитрит-иона NO2-? Какой фактор определяет различное поведение нитрит-иона в исследуемых реакциях?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Используя электронно-ионный метод, составьте полные уравнения реакций, выраженных следующими схемами:



___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Что происходит с оксидом азота (II) на воздухе в первой и третьей пробирках?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. К каким типам ОВР относятся данные реакции?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Ответы на контрольные вопросы
1. Сколько молей HNO3 необходимо взять для окисления меди в реакции, протекающей по уравнению:
Cu + HNO3 (разб.) ® Cu(NO3)2 +NO + …?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Напишите полное молекулярное уравнение следующих реакций, составив при этом частные уравнения процессов окисления и восстановления. Определите, какую роль играет в каждом случае перекись водорода:
H2O2 + KI + H2SO4 ® I2 + K2SO4 + H2O;
K2Cr2O7 + H2O2 + H2SO4 ® Cr2(SO4)3 + О2 + K2SO4 + H2O.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Используя электронно-ионный метод, составьте полное молекулярное уравнение реакции:
KMnO4 + KBr + H2O ® … + Br2 + KOH
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________