КОФЕРМЕНТ G
биосинтез КАРОТИНОИДЫ
АКТИВНЫЕ ФОРМЫКИСЛОРОД/
КОФЕ
РАСТИТЕЛЬНЫЕ АНТИО1
ТЕОРИИ СТА
АРОТИН
ФЕНОЛЬНЫЕ АНТИОК
Л
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Е. И. Шарова
АНТИОКСИДАНТЫ
РАСТЕНИЙ
УЧЕБНОЕ ПОСОБИЕ

ИЗДАТЕЛЬСТВО САНКТ-ПЕТЕРБУРГСКОГО УНИВЕРСИТЕТА
УДК 581.19(075)
ББК 28.57 Ш25
Рецензенты: проф. И. П. Гаврилюк (ВНИИ растениеводства им. Н. И. Вавилова); проф. И. М. Кис- люк (Ботан. ин-т им. В. Л. Комарова РАН); проф. Н. Д. Ещенко и доц. О. В. Галкина (С.-Петерб. гос. ун-т)
Печатается по решению
Учебно-методической комиссии
биологического факультета
С.-Петербургского государственного университета
Шарова Е. И.
Ш25 Антиоксиданты растений: учеб. пособие. — СПб.: Изд-во С.-Петерб. ун-та. 2016. — 140 с.
ISBN 978-5-288-05641-3
В пособии рассмотрена роль антиоксидантов растений в защите от активных форм кислорода (АФК) — продуктов метаболизма всех аэробных организмов, включая растения, животных и человека. Подробно описаны механизмы возникновения различных АФК в клетках и те угрожающие жизни процессы, которые вызывают АФК. Особое внимание уделено механизмам пероксидации липидов и свободнорадикальным теориям старения. Проанализировано понятие «антиоксидант» и сделан обзор методов оценки антиоксидантной активности. Центральную часть книги занимают главы, в которых рассмотрены основные группы растительных антиоксидантов: аскорбиновая кислота, терпеноидные хиноны, каротиноиды, пептиды, фенольные соединения. Представлена информация о биосинтезе, окислительновосстановительных превращениях и рециклизации антиоксидантов, описаны их функции в растениях. Критически обсуждена роль растительных антиоксидантов в питании человека.
Учебное пособие предназначено для студентов и аспирантов, изучающих биохимию растений, а также для широкого круга лиц, интересующихся вопросами функционального питания.
ББК 28.57
К изданию рукопись подготовлена при финансовой поддержке
исследовательского гранта РФФИ № 14-04-01624
 © С.-Петербургский государственный университет, 2016
© С.-Петербургский государственный университет, 2016
ПРЕДИСЛОВИЕ
Антиоксиданты — тема очень популярная как в научной литературе, так и в средствах массовой информации. Этим веществам ежегодно посвящаются сотни тысяч научных статей, десятки книг. СМИ ежечасно агитируют приобретать различные препараты с высокой антиоксидантной активностью. Эта реклама изобилует грубейшими ошибками: неправильно произносятся названия веществ, неверно расставляются ударения в словах. Подобная реклама не столько информирует, сколько дезинформирует людей о свойствах антиоксидантов. В данных обстоятельствах автор, в течение многих лет преподающий биохимию растений в Санкт- Петербургском университете, ощутила необходимость изложить профессиональный взгляд на растительные антиоксиданты. Конечно, только читатель, знакомый с основами биохимии, сможет в полной мере осмыслить содержание книги. Тем не менее автор стремилась таким образом излагать материал, чтобы даже неподготовленный читатель смог извлечь для себя полезную информацию об антиоксидантах растений.
Изучение антиоксидантов составляет раздел редокс-биологии — науки о редокс-превраще- ниях в живых организмах. У аэробных организмов большинство окислительно-восстановительных химических реакций (редокс-реакций) происходит с участием молекулярного кислорода и катализируется ферментами. Однако существует немало спонтанных превращений, среди которых наибольшее внимание ученых привлекают реакции, вызываемые активными формами кислорода (АФК) и приводящие к необратимым окислительным повреждениям важнейших биомолекул. Функция антиоксидантов состоит в том, чтобы предотвращать эти реакции.
Таким образом, антиоксидант — антагонист АФК. Диалектика подсказывает, что эти две противоположности не только борются друг с другом, но и составляют неразрывное единство. Новые научные факты подтверждают данную идею. Оказалось, что АФК необходимы для жизнедеятельности. Они регулируют рост и развитие живых организмов, участвуют в защитных реакциях на неблагоприятные воздействия, в заживлении повреждений. Постепенно формируется представление о совокупности антиоксидантов и прооксидантов как части гомеостаза — системы поддержания внутренней среды живых клеток.
Растительная биохимия существенно богаче биохимии животных. Неудивительно, ведь растения синтезируют все нужные им органические молекулы, тогда как животные во многом полагаются на готовые биомолекулы, поступающие с пищей. Это касается и антиоксидантов. Наш организм не способен сам синтезировать аскорбиновую кислоту, каротиноиды, флавоноиды и другие фенольные вещества. Поэтому растительная пища служит для человека источником не только питательных веществ, но и антиоксидантов.
В этой книге описание важнейших антиоксидантов растений включает характеристику их физико-химических свойств, биосинтеза, окислительно-восстановительных превращений, рециклизации, функций. Излагая данный материал, автор руководствовалась следующими общими идеями об антиоксидантах растений:
1) они не столько подавляют, сколько контролируют протекание спонтанных окислительных реакций в живых клетках;
2) их функции не ограничены антиоксидантной активностью;
3) среди них есть универсально распространенные в живой природе, и такие антиоксиданты нужно рассматривать в сравнительном аспекте;
4) многие из них составляют непременный элемент питания человека, поэтому необходимо обсудить, что с ними происходит в нашем организме.
Традиционно при описании антиоксидантов их делят на две группы:
1) молекулы, непосредственно участвующие в гашении АФК (например, аскорбиновая кислота);
2) ферменты, убирающие АФК каталитическим путем (например, аскорбатпероксидаза).
Стремление показать значение антиоксидантов растений для человека заставило автора отказаться от хрестоматийной схемы. Ферменты антиоксидантной защиты рассмотрены в главах, посвященных их субстратам: супероксиддисмутазы и каталазы при описании АФК, ферменты глутатионового и аскорбат-глутатионового циклов при описании глутатиона и аскорбиновой кислоты.
В основу книги положены спецкурсы «Антиоксиданты растений» и «Активные формы кислорода у растений», которые автор читает студентам биологического факультета Санкт- Петербургского государственного университета.
СПИСОК СОКРАЩЕНИЙ
АБК — абсцизовая кислота
АДФ — аденозиндифосфорная кислота
АК — аскорбиновая кислота восстановленная
АМФ — аденозинмонофосфорная кислота
АТФ — аденозинтрифосфорная кислота
АФК — активные формы кислорода
ГДФ — гуанозиндифосфорная кислота
ГТФ — гуанозинтрифосфорная кислота
ДАК — дидегидроаскорбиновая кислота
ДНК — дезоксирибонуклеиновая кислота
ЖК — жирная кислота
ИУК — индол-3-уксусная кислота (ауксин)
КоА — коэнзим А
МДАК — монодегидроаскорбиновая кислота
РНК — рибонуклеиновая кислота
СОД — супероксиддисмутаза
УДФ — уридиндифосфорная кислота
УФ — ультрафиолет
ФАД — флавинадениндинуклеотид
Фд — ферредоксин
ФМН — флавинмононуклеотид
GSH — глутатион восстановленный
GSSG — глутатион окисленный (глутатион-дисульфид)
NAD+ — никотинамидадениндинуклеотид окисленный
NADH — никотинамидадениндинуклеотид восстановленный
NADP+ — никотинамидадениндинуклеотидфосфат окисленный
NADPH — никотинамидадениндинуклеотидфосфат восстановленный Pi — фосфат PPi — пирофосфат
ГЛАВА 1
АКТИВНЫЕ ФОРМЫКИСЛОРОДА
И МЕХАНИЗМЫИХ ГЕНЕРАЦИИ В КЛЕТКАХ
АЭРОБНЫХ ОРГАНИЗМОВ
Кислород — один из четырех органогенных элементов (С, Н, N, О), из которых построены все органические вещества, встречающиеся у живых существ. Молекулярный кислород (О2) необходим для эффективного извлечения химической энергии, запасенной в углеводах, липидах и белках. С его помощью ферменты класса оксидоредуктаз осуществляют сотни тысяч жизненно важных окислительных реакций. Активные формы кислорода (АФК) — неизбежные участники аэробного метаболизма. Их «активность» проявляется в том, что они спонтанно, то есть без помощи ферментов, реагируют с органическими молекулами, что обычно приводит к повреждению последних. В ходе эволюции живые организмы научились не только бороться с АФК, но и использовать их. Этим объясняется существование многочисленных ферментов, генерирующих АФК. Таким образом, у живых организмов АФК возникают спонтанно, как побочные продукты протекающих с участием молекулярного кислорода процессов, а также ферментативным путем.
1.1. Роль кислорода в эволюции жизни на Земле
Когда первые живые существа возникли на Земле, в ее атмосфере было мало О2 (доли процента), но эти организмы в нем не нуждались — они были анаэробами. Кислород появился в атмосфере Земли в значительных количествах примерно 2,5 миллиарда лет назад, главным образом в результате эволюции фотосинтеза у цианобактерий (синезеленых водорослей). Цианобактерии приобрели способность расщеплять воду, поглощая энергию Солнца, для извлечения атомов водорода и использования его восстановительного потенциала. Побочным продуктом при этом оказался молекулярный кислород, который тоннами выбрасывался в атмосферу:
6СО2 + 6Н2О С6Н12О6 + 6О2.
2 2 6 12 6 2
Это, безусловно, был один из ранних в истории Земли процессов загрязнения
атмосферы продуктами жизнедеятельности. Первоначально большая часть генери-
руемого цианобактериями кислорода взаимодействовала с металлами и превращала
их в окислы металлов, которые дошли до наших дней в форме камней и руд. Только после завершения процесса окисления металлов кислород стал накапливаться в атмосфере. Накопление кислорода было полезным для живых организмов в двух отношениях. Оно привело:
1) к образованию озонового слоя в стратосфере, защищающего Землю от УФ-С-
радиации — электромагнитных волн длиной 100-280 нм. Это помогло организмам выйти из моря и колонизировать сушу; а также
2) к удалению растворенного в Мировом океане Fe2+ вследствие образования его нерастворимых комплексов с кислородом. В чем польза от удаления Fe2+ из раствора? Этот переходный металл, как и Cu+, быстро реагирует с Н2О2, производя токсичный гидроксил-радикал:
Fe2+ + НО Fe3+ + • ОН + ОН-.
Реакцию открыл Генри Фентон в 1894 г.
Накопление кислорода в атмосфере привело к гибели большинства анаэробов. Выжили только те организмы, которые смогли перестроить свой метаболизм (стать аэробами) либо найти аноксическую среду. Эта среда и составляет местообитание современных анаэробов, для которых смертелен контакт с атмосферой, содержащей кислород.
Эволюционисты предполагают, что адаптация к накапливающемуся в атмосфере О2 началась с появления белков, связывающих (хелатирующих) железо и таким образом защищающих клетки от «фентоновской химии» — многочисленных деструктивных процессов, порождаемых реакцией Фентона. В плазме крови человека эту функцию выполняют ферритин, одна олигомерная молекула которого связывает до 4500 ионов железа, и церулоплазмин, связывающий ионы меди. Организмы, которые приобрели толерантность к О2, начали использовать кислород для метаболических превращений, катализируемых оксидазами, оксигеназами и гидроксилазами. В результате появилось много полезных веществ, например коллаген, необходимый всем животным для построения хрящей и костей.
Затем живые существа стали использовать О2 для эффективной выработки энергии, создав электрон-транспортные цепи, в которых О2 выступал терминальным акцептором электронов. Этот переход к аэробному метаболизму в 15 раз увеличил выход АТФ, который можно получить при окислении биомолекул, например глюкозы.
Но почему предки цианобактерий сразу же не погибли от вырабатываемого ими молекулярного кислорода? Эволюционисты предполагают, что некоторые антиоксиданты существовали даже тогда, когда в атмосфере Земли было не более 0,1% О2. УФ-лучи бомбардировали Землю, лишенную озонового экрана, и превращали имеющийся в воде О2 в Н2О2. В те времена в воде было растворено много Fe2+, поэтому возникала угроза протекания реакции Фентона. У предков цианобактерий должны были появиться системы для разрушения Н2О2 — каталазоподобные ферменты, проводящие следующую реакцию:
Н2О2 + Н2О2 + 2Н2О + О2.
Эти ферменты, разлагающие Н2О2, позднее приобрели способность разлагать воду. Так в эволюции возник кислородвыделяющий комплекс фотосинтетического аппарата.
В истории Земли были периоды, когда концентрация атмосферного кислорода значительно превышала современную. В каменноугольном периоде она достигала 35%. В это время процветала растительность, уровень СО2 упал и образовались огромные отложения угля и нефти, которые мы сейчас используем, повышая при этом уровень СО2 в атмосфере. У растений и животных, живших в каменноугольном периоде, должна была сформироваться особенно сильная антиоксидантная защита. Поэтому для биологии активных форм кислорода значительный интерес представляет изучение древних видов. Ведь даже сейчас они лучше переносят повышенные концентрации О2, чем виды, возникшие в более поздние времена.
Все аэробы, включая бактерий, растения, животных и человека, страдают, когда подвергаются воздействию О2 в высоких концентрациях. Окислительные повреждения у них происходят и при нормальных концентрациях О2. Причем сам молекулярный кислород довольно инертен в химическом отношении. Его токсичность связана с тем, что он служит источником активных форм кислорода (АФК).
1.2. Молекулярная характеристика АФК
Многие химически активные формы О2 представляют собой свободные радикалы и ведут к появлению свободных радикалов и протеканию свободнорадикальных реакций. Свободный радикал — элемент, атом или группа атомов, способный к независимому существованию и содержащий один или более неспаренных электронов.
Неспаренный электрон один занимает целую атомарную или молекулярную орбиталь. Простейший свободный радикал — атом водорода (Н -).
Радикалы могут возникнуть в результате гомолитического расщепления С-С, С-Н, С-О связей, но такие химические связи трудно разорвать. Есть связи, которые рвутся легко. Например, дисульфидная связь может разорваться даже при механическом воздействии: -S-S- -+ -S ’ + ’ S-, а пероксидная — под действием ультрафиолета: Н-О-О-Н Н-О ’ + • о-н.
Свободные радикалы, и не только кислородные, в большинстве своем чрезвычайно химически активны. Важнейшие АФК, присутствующие в живых организмах, приведены ниже:
• ОН — Гидроксил-радикал
О2 - - — Супероксид-радикал
IKK — Гидропероксил-радикал (протонированный супероксид-радикал)
RO - — Алкоксил-радикал
LO - — Липидный алкоксил-радикал
ROO - — Алкил-пероксил-радикал
LOO - — Липидный пероксил-радикал
1O2 — Синглетный кислород
Н2О2 — Пероксид (перекись) водорода
ROOI — Гидропероксид (органическая перекись)
LOOI — Гидропероксид (гидроперекись) липида
Рассмотрим электронное строение так называемых первичных АФК — прямых неорганических производных молекулярного кислорода (рис. 1). В своем основном, триплетном, состоянии (3О2) молекулярный кислород представляет собой свобод-
| а*2р ф | о | о | о |
| тг*2Р ф ф | ©о | ©© | ©© |
| * 2р ф (ф | ©© | ©© | ©© |
| <7 2р © | © | © | © |
| (7* 2s © | © | © | © |
| о- 2s (ф | © | © | © |
| (7*ls (ф | © | © | © |
| <7 Is (ф | © | © | © |
| 02 | 102 | ОГ | о22- |
Рис. 1. Электронное строение триплетного кислорода (О2) и его активных форм
ный радикал, но, несмотря на это, он относительно инертен и не рассматривается
как АФК. Электроны, занимающие в атоме кислорода атомарные p-орбитали второго энергетического уровня (2p), при объединении двух атомов в молекулу 3О2 занимают молекулярные п- и а-орбитали таким образом, что появляется два неспаренных электрона с одинаковыми спинами. Параллелизм спинов этих неспаренных электронов объясняет низкую химическую реактивность 3О2. Он накладывает на нее так называемое спиновое ограничение.
Молекулярный кислород в основном состоянии легко окисляет соединения с двумя неспаренными электронами, имеющими параллельные спины. Но такие соединения встречаются редко. Он также легко принимает один неспаренный электрон, то есть легко взаимодействует со свободными радикалами. Двухэлектронное и четырехэлектронное восстановление 3О2 до O/- (Н2О2) и 04- (Н2О), соответственно, происходящее in vivo в разнообразных реакциях биологического окисления, опирается на серию катализируемых ферментами одноэлектронных восстановлений молекулярного кислорода. Ферменты, осуществляющие восстановление молекулярного кислорода, обычно имеют радикал в активном центре, например ион железа.
Синглетный кислород (1О2) был открыт в 1964 г. — почти на двести лет позднее триплетного, открытого Джозефом Пристли в 1772 г. Он не является свободным радикалом, так как у него нет неспаренного электрона (рис. 1). У синглетного кислорода спиновое ограничение снимается в результате изменения спина одного из p-электронов. Поэтому он легко окисляет многие вещества и из-за своей высокой химической реактивности имеет очень короткие время жизни (несколько микросекунд) и длину пробега (0,02-0,15 мкм).
В живых организмах постоянно генерируется О/ _ — супероксид-радикал (рис. 1). У супероксид-радикала спиновое ограничение снимается благодаря присоединению к молекулярному кислороду одного электрона. В кислой среде супероксид-радикал протонируется и переходит в форму гидропероксил-радикала: О/ - + H+ HO/ (pKa 4,8).
Пероксид-радикал (O22-, в протонированной форме — пероксид водорода Н2О2), образующийся при добавлении еще одного электрона к супероксид-радикалу, значительно активнее молекулярного кислорода (рис. 1). У него ослаблена связь между атомами кислорода. Однако это наиболее стабильная и наименее реактивная АФК. Поэтому пероксид водорода может в значительных количествах накапливаться в клетках и перемещаться из одного компартмента клетки в другой, пересекая биологические мембраны.
1.3. Генерация АФК фотосенсибилизаторами
Фотосенсибилизатор — это органическая молекула, которая, поглощая фотон, переходит в возбужденное состояние, затем вызывает химическое превращение другой молекулы и возвращается в исходное состояние. Основной первичной мишенью фотосенсибилизаторов в аэробных условиях является триплетный кислород, который превращается в высокореактивный синглетный.
У растений мощным фотосенсибилизатором выступает хлорофилл. Поэтому в процессе фотосинтеза в хлоропластах интенсивно образуется 1О2 (рис. 2). Его образование — результат неадекватной диссипации (рассеивания) избытка энергии хлорофилла, перешедшего в триплетное состояние. Триплетный хлорофилл может передавать свое возбуждение на 3О2, превращая его в 1О2. Свойствами фотосенсибилизаторов обладают и другие порфирины, а также их предшественник б-аминолевулиновая кислота. Эти свойства также проявляют все производные флавина.
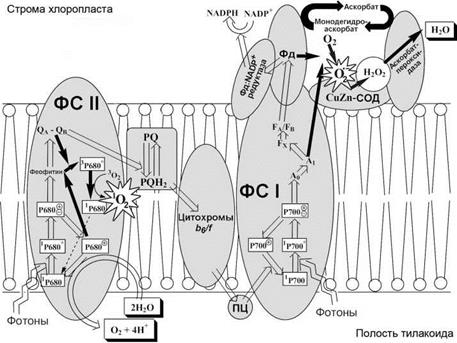
Рис. 2. Образование АФК в электрон-транспортной цепи хлоропластов (по: Asada, 2006).
P680 и P700 — возбужденные молекулы хлорофилла; PQ и PQH2 — окисленный и восстановленный пластохинон, соответственно; QA и QB — хиноны, принимающие электроны от хлорофиллов в фотосистеме II (ФС II); Фд — ферредоксин; A0, A1, FX, FA, FB — акцепторы электронов от возбужденного хлорофилла в фотосистеме I (ФС I); ПЦ — пластоцианин, СОД — супероксиддисмутаза
Кроме того, растения синтезируют широкий спектр вторичных соединений, генерирующих синглетный кислород на свету. Такие соединения локализуются в вакуолях и не причиняют вреда самим растениям, но защищают их от растительноядных животных. Яркий пример — гиперицин. Это фенольное соединение накапливается у лекарственного растения Hypericum perforatum (зверобоя продырявленного). Известно, что поедание скотом на пастбищах зверобоя в больших количествах приводит к тяжелым поражениям кожи из-за свободнорадикальных реакций окисления, которые вызывает гиперицин, возбуждаясь под действием солнечных лучей. Не случайно растение называется зверобоем. Передозировка гиперицина, используемого как антидепрессант, опасна и для человека.
У животных роль фотосенсибилизаторов играют рибофлавин, миоглобин, протопорфирин. Возбуждаясь под действием света, они приводят к образованию 1О2 в кожных покровах и органах зрения.
1.4. Генерация АФК в электрон-транспортных цепях хлоропластов и митохондрий
Главный источник АФК у растений — электрон-транспортная цепь хлоропластов, а у животных — электрон-транспортная цепь митохондрий.
Реакция образования супероксид-радикала в хлоропластах называется реакцией Мелера. Фотовосстановление молекулярного кислорода до пероксида водорода (Н2О2) было открыто Аланом Мелером в 1951 г. Двадцать лет спустя Кози Асада с соавторами выяснили, что первичным продуктом восстановления кислорода является супероксид-радикал, который затем превращается в Н2О2 (рис. 2). Одноэлектронное восстановление О2 происходит за счет ферредоксина (Фд) — белка, содержащего железосерные кластеры. Эта реакция является побочной в нормальном
процессе двухэлектронного восстановления NADP+, катализируемом ферредоксин:
NADP+редуктазой.
В митохондриях супероксид-радикал образуется в комплексах I и III (рис. 3).
Восстановление кислорода в комплексе I может происходить в результате передачи электронов от восстановленного флавинмононуклеотида (ФМН), а также от железосерных кластеров. В комплексе III основным продуцентом супероксид-радикала является Q-цикл (рис. 4).
Функционирование Q-цикла — важный способ создания градиента рН на сопрягающих мембранах митохондрий и хлоропластов. Восстановленный кофермент QH2 (убихинол) в сайте своего окисления (Qo-сайте), расположенном на наружной, обращенной в межмембранное пространство стороне сопрягающей мембраны митохондрий, передает один электрон на железосерные кластеры (Fe—S) белка Риске и далее в комплекс IV, а второй электрон — на низкопотенциальный гем цитохрома b566 (bL), затем на высокопотенциальный гем цитохрома b562 (bH), который способен восстанавливать окисленный убихинон (Q) до семиубихинона (QI Г) и затем до уби- хинола на внутренней стороне мембраны (в Qi-сайте), обращенной в митохондриальный матрикс.
В результате двух оборотов этого цикла два убихинола окисляются в Qo-сайте, один восстанавливается в Qi-сайте, два электрона передаются в комплекс IV, два протона выкачиваются из матрикса и четыре протона закачиваются в межмембранное
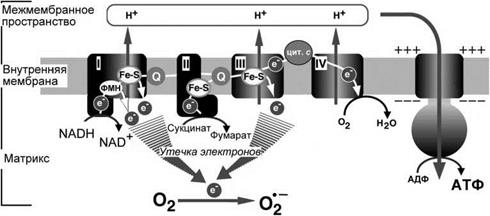
Рис. 3. Образование АФК в электрон-транспортной цепи митохондрий (по: Ohta, 2012).

Рис. 4. Образование АФК в Q-цикле электрон-транспортной цепи митохондрий
пространство. Таким образом, в результате окисления одного убихинола достигается увеличение протонного градиента между внутренней и наружной сторонами сопрягающей мембраны на шесть протонов и увеличение разности потенциалов на мембране на два отрицательных заряда за счет двух электронов, перемещающихся из межмембранного пространства в матрикс.
Семиубихинон, как видно из приведенного описания, образуется в Qi-сайте
как промежуточный продукт восстановления в этом сайте убихинона до убихино-
ла. Однако в результате ряда побочных реакций семиубихинон возникает также и в Qo-сайте. Именно здесь, как было недавно установлено, происходит образование супероксид-радикала в результате передачи одного электрона от семиубихинона на молекулярный кислород.
1.5. Генерация АФК NADPH-оксидазами плазматической мембраны
Мощными продуцентами супероксид-радикала у животных и растений являются расположенные в плазматической мембране NADPH-оксидазы, которые окисляют NADPH на цитозольной стороне, а электроны переносят на О2, находящийся на внешней стороне мембраны, превращая его в супероксид-радикал. Впервые активность этого фермента была обнаружена у фагоцитов крови млекопитающих, способных реагировать на бактериальные клетки «окислительным взрывом» (respiratory burst) — массированным выбросом в область контакта с патогеном активных форм кислорода. Ферментативный комплекс состоит из шести субъединиц, включая содержащую цитохром b558 субъединицу gp91-PHOX (gp —glycoprotein, 91 — 91 kilodalton, PHOX — phagocytic oxidase).
В 1990-е годы было показано наличие у растений белков, гомологичных gp91- PHOX фагоцитов крови млекопитающих. В дальнейшем эти белки были детально охарактеризованы методами молекулярной биологии. Растительные гомологи NADPH-оксидаз фагоцитов кодируются семейством генов Rboh (respiratory burst oxidase homologs), экспрессия которых связана с реакцией «окислительного взрыва» на атаку фитопатогенов.
NADPH-оксидазы растений состоят из одной полипептидной цепи, включающей 300 аминокислотных остатков, которая в форме а-спиралей шесть раз пересекает плазматическую мембрану (рис. 5). На цитоплазматической стороне находится NADPH-связывающий домен. В состав белка входят ФАД и два гема, представленные цитохромом b558. Гемы находятся внутри мембраны и связаны с белком с помощью четырех консервативных остатков гистидина (H). В отличие от NADPH-оксидазы фагоцитов, растительный фермент имеет длинный гидрофильный N-конец. На этом конце, расположенном на цитоплазматической стороне мембраны, имеются две EF-руки, способные связывать Ca2+.

Рис. 5. Строение NADPH-оксидазы плазматической мембраны растений (по: Sagi, Fluhr, 2006)
У арабидопсиса имеется десять генов Rboh, экспрессия которых сильно различается. Некоторые гены экспрессируются конститутивно, другие — в зависимости от стадии развития, третьи — в ответ на различные стрессовые воздействия (гипоксию, атаку фитопатогенов, засоление). Эти ферменты выполняют множество функций. Наиболее изучена их роль в реакции окислительного взрыва в апопласте, вызываемой фитопатогенами, засолением и гипоксией, в АБК-зависимом закрывании устьиц и в процессе формирования корневых волосков.
Вырабатываемый Rboh супероксид-радикал может иметь непосредственное защитное значение в качестве компонента окислительного взрыва. Кроме того, он может служить сигналом, вызывающим глубокие перестройки функционирования клетки, важные не только для адаптации, но и для процессов роста и развития.
Сигнальная функция супероксид-радикала тесно связана с кальциевой сигнализацией. Наиболее ярко это показано на примере формирования корневых волосков и АБК-зависимого закрывания устьиц. Формирование корневых волосков происходит благодаря полярному, верхушечному росту отдельных клеток ризодермы корня. Верхушечный рост связан с входом Ca2+ в клетку на ее «верхушке» и с локализованной здесь везикулярной секрецией. С помощью флуоресцентного красителя, чувствительного к АФК, было показано, что в процессе образования корневого волоска, занимающем примерно один час, в его растущем кончике генерируются АФК.
Мутанты арабидопсиса rhd2 (root hair defective) имеют короткие утолщенные корневые волоски и корни вместо длинных и тонких. У этих мутантов нарушен процесс генерации АФК и поглощения кальция в кончике корневого волоска. Белок RHD2 оказался NADPH-оксидазой плазматической мембраны (AtRboh С). Если корни растения дикого типа обработать ингибитором этого фермента, то можно получить фенокопию мутанта. Напротив, если корни мутанта обработать гидроксил-радикалом, то на их поверхности возникнут вздутия, в какой-то мере имитирующие корневые волоски. Генерируемые RHD2 активные формы кислорода могут вызывать активацию потенциалзависимых Ca2+-каналов плазматической мембраны, через которые в клетки входит кальций. Высокая активность RHD2 наблюдается и в зоне растяжения корней, где также интенсивно поглощается Ca2+, необходимый для растяжения клеток.
С активностью NADPH-оксидазы плазмалеммы связана реакция закрывания устьиц в ответ на АБК. Под действием АБК происходит активация AtRbоh В и AtRbоh F, которые вырабатывают АФК, что приводит к открыванию потенциалзависимых Ca^-каналов плазмалеммы и входу Ca2+ в клетку. Повышение концентрации Ca2+ в цитоплазме, в свою очередь, увеличивает активность NADPH-оксидазы плазматической мембраны благодаря связыванию Ca2+ с EF-руками фермента.
1.6. Генерация АФК пероксидазами
Пероксидазы растений относятся к III классу (ЕС 1.11.1.7) суперсемейства растительных, бактериальных и грибных пероксидаз, содержащих геминовое железо. Пероксидазы этого класса иначе называют гваяколпероксидазами, так как они наиболее активны по отношению к фенолам и эту активность in vitro часто тестируют, используя цветную реакцию окисления гваякола. Их также называют секреторными пероксидазами, так как они локализованы преимущественно в клеточных стенках и вакуолях. Ниже, описывая пероксидазы III класса, мы будем называть их просто пероксидазами.
Давно известно, что пероксидазы накапливаются в клеточных стенках стареющих тканей. Они могут проявлять пероксидазную и оксидазную активность, используя в качестве акцептора электронов пероксид водорода и молекулярный кислород, соответственно. Важная особенность каталитической активности этого фермента состоит в производстве свободных радикалов, которые могут вступать в спонтанные реакции. Протекание этих реакций зависит от присутствия в среде Mn2+ и фенольных кофакторов. Некоторые интермедиаты и продукты свободнорадикальных реакций также являются субстратами пероксидазы. Множество параллельно протекающих каталитических и спонтанных реакций отчасти объясняет необычно большое разнообразие реакций, катализируемых пероксидазами.
В процессе своей каталитической активности фермент находится в нескольких состояниях, с разной степенью окисленности молекулы. Молекулярные состояния фермента можно легко идентифицировать по различиям в спектре поглощения видимого света. В классическом пероксидазном цикле нативный фермент E(Fe3+) вначале взаимодействует с Н2О2 и переходит в соединение I — E(Fe3+O). Далее окисленный фермент восстанавливается в результате двух последовательных одноэлектронных окислений фенольного субстрата (PhOH), превращаясь вначале в соединение II — E(Fe3+O-) — и затем возвращаясь в исходное нативное состояние (ground state):
E(Fe3+) + Н2О2 E(Fe3+O) + Н2О,
E(Fe3+O) + PhOH E(Fe3+O-) + PhO\
E(Fe3+O-) + PhOH E(Fe3+) + PhO ^ + Н2О.
Таким образом, классический пероксидазный цикл обеспечивает протекание
следующей реакции: 2PhOH + Н2О2 2PhO ^ + 2Н2О.
Феноксильные радикалы (PhO ^), как правило, гасятся, взаимодействуя друг с другом и образуя димеры, олигомеры или такой полимер, как лигнин.
Пероксидазная реакция может протекать без кофакторов. Если в среде инкубации присутствуют сильные восстановители, то феноксильные радикалы могут восстанавливаться за их счет и таким образом выступать в роли кофакторов окисления пероксидазами этих восстановителей. Наиболее яркий пример такого окисления представляет реакция окисления гваяколпероксидазой аскорбиновой кислоты. В отсутствие фенолов гваяколпероксидаза окисляет аскорбиновую кислоту с очень низкой скоростью. При добавлении фенолов, например феруловой кислоты, скорость окисления аскорбиновой кислоты возрастает в сотни раз. Таким образом, аскорбиновая кислота вызывает лаг-фазу в реакции окисления фенолов пероксидазами, продолжительность которой определяется количеством аскорбиновой кислоты в реакционной среде.
Некоторые восстановители, подвергаясь одноэлектронному окислению перок- сидазой в форме соединений I и II, превращаются в свободные радикалы, вступающие во взаимодействие с молекулярным кислородом и таким образом генерирующие АФК. Это происходит при окислении пероксидазами NAD(P)H, салициловой кислоты, некоторых ароматических аминов, хитоолигосахаридов. Наиболее полно изучен процесс окисления NADH, состоящий из 8 основных реакций:
NADH + О2 NAD+ + Н2О2, (1)
E(Fe3+) + Н2О2 E(Fe3+O) + Н2О, (2)
E(Fe3+O) + NADH E(Fe3+O-) + NAD ', (3)
E(Fe3+O-) + NADH E(Fe3+) + NAD ', (4)
NAD ' + O2 NAD+ + О2, (5)
NADH + О2- NAD ' + Н2О2, (6)
О ' 2 + О ' 2 О2 + Н2О2, (7)
E(Fe3+) + О2 E(Fe3+O2-). (8)
Для «затравки» требуются следовые количества Н2О2, которые возникают в процессе спонтанного окисления NADH в водном растворе (1). Далее следуют реакции
классического пероксидазного цикла (2-4), в результате которых образуются радикалы NAD ', вступающие в реакцию с молекулярным кислородом и генерирующие О ' 2- (5). Супероксид-радикал окисляет NADH и превращается в Н2О2 (6), который используется в реакциях пероксидазного цикла (2-4). Реакция (6) многократно ускоряется ионами Mn2+. Поэтому в присутствии Mn2+ окисление NADH пероксидазой протекает во много раз быстрее. Кроме того, в реакционной среде наблюдается спонтанная дисмутация О ' 2- (7). В итоге протекания этих реакций NADH окисляется до NAD+, а O2 восстанавливается до Н2О2:
NADH + О NAD+ + НО.
2 2 2
Осуществлению классического пероксидазного цикла во время окисления NADH препятствует то, что фермент под действием О ' 2- переходит в форму соединения III (8), неактивного в пероксидазном цикле. Возвращение фермента в нативную форму происходит спонтанно или с помощью Н2О2, однако очень медленно. В последнем случае пероксидаза, вначале переходя с помощью О'2- в соединение III, а затем возвращаясь в нативную форму, фактически катализирует реакцию Хабера—Вайса:
О2- + НО O + ' ОН + ОН-.
2 2 2 2
Выход из соединения III возможен также при участии NAD ':
Е(Бе3+О2-) + NAD ' E(Fe3+O) + NAD+ + Н2О.
В присутствии некоторых фенолов окисление NADH многократно усиливается из-за того, что фенолы могут:
1) возвращать соединение III в нативный фермент:
Е^е3+О2-) + PhOH E(Fe3+) + PhO ' + Н2О2;
2) окисляться пероксидазой до феноксильных радикалов, которые, взаимодействуя с NADH, восстанавливаются, производя новые радикалы NAD '.
В качестве фенольного кофактора в реакции in vitro обычно используется 2,4-дихлорфенол. Природными кофакторами NADH-оксидазной реакции, по-видимому, служат содержащиеся в клеточных стенках фенольные соединения: р-кумаровая, фе- руловая, синаповая кислоты и их спирты. Остается также открыт