ОТЧЕТ
по лабораторной работе
по дисциплине «Теория электрометаллургических процессов»
«Определение характеристик электролитического получения цинка»
Выполнил:
Бренич Н.В.,
гр. НМТЗ-542221
Проверил:
,
каф. металлургии цветных металлов
Екатеринбург, 2018г.
1. Цель работы - экспериментальное определение основных характеристик электролитического получения цветных металлов на примере цинка: определение величин напряжения разложения, обратной ЭДС, рабочего напряжения, выхода по току, удельного расхода электроэнергии, выхода по энергии в исходном и конечном электролитах, применяемых в промышленной практике.
2. Теоретические основы
Процесс электролиза характеризуется величинами напряжения разложения, обратной ЭДС, рабочего напряжения, выхода по току, выхода по энергии, удельного расхода электроэнергии.
Минимальное значение напряжения, которое необходимо приложить к электродам, чтобы начался процесс электролиза с образованием электродных продуктов, называется напряжением разложения (Ен.р).
Методика определения напряжения разложения по кривым i-h и i-U показана на рис. 7.2.

А б
Рис. 7.2. Вид поляризационных кривых в координатах:
i – h (a), I – U (б)
Напряжение разложения может быть также найдено как разность равновесных потенциалов для электродных реакций, реализующихся на аноде и катоде.
Е н.р может быть вычислено и по величинам изменения энергии Гиббса D G р, соответствующей электрохимической реакции
Е н.р = 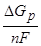 . (7.5)
. (7.5)
Величина обратной ЭДС (Е обр) при определенных i a и i к включает в себя напряжение разложения и величины катодной и анодной поляризации при рассматриваемых плотностях тока (рис. 7.3):
Е обр = Е н.р + hа + hк. (7.6)
С другой стороны величина обратной ЭДС равняется рабочему напряжению на электролизере за вычетом омического падения напряжения в электролите и электродах:
IR = IR эл + IR эд .
Е обр = U р – IR. (7.7)
Обратная ЭДС определяется в момент отключения тока электролиза (рис. 7.3).
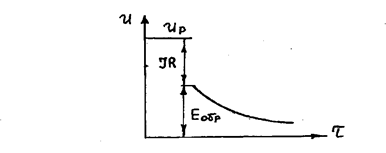
Рис.7.3. Принцип определения обратной ЭДС
Со временем Е обр. уменьшается из-за снижения величин поляризации.
Величина рабочего напряжения, измеряемого на электролизере, равна
U p = Е н.р + h к + h а + IR эл + IR эд + IR пр, (7.8)
где IR пр – падение напряжения в подводящих проводах (ошиновке электролизера).
Важнейшей характеристикой процесса электролиза является величина выхода по току.
Выходом по току h т называется отношение количества вещества, фактически образовавшегося на электроде (m факт), к количеству вещества, которое должно было бы образоваться в соответствии с законом Фарадея (m теор).
Выход по току выражается в долях единицы либо в процентах:
h т=  либо
либо  100%. (7.9)
100%. (7.9)
Значение m факт определяется взвешиванием, mтеор рассчитывается по уравнению (7.10).
m теор = q I τ, (7.10)
где q – электрохимический эквивалент цинка 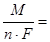
 1,22 г / А·ч;
1,22 г / А·ч;
I – сила тока, А;
τ – время электролиза в ч.
Выход по току, как правило, не равен 100%, потому что часть тока расходуется на побочные процессы (i поб).
В частности, на разложение более легко восстановимых веществ расходуется остаточный ток i o (см. рис.7.2). В том случае, если это единственный побочный процесс, выход по току при определенной плотности тока i может быть найден по уравнению
h т =  . (7.11)
. (7.11)
Доля тока, расходуемая на побочные реакции, в принципе не одинакова для катодного и анодного процессов, поэтому различают катодный и анодный выходы по току. Необходимо также помнить, что выход по току, строго говоря, не остается постоянным во времени, а изменяется с изменением условий электролиза, поэтому различают выходы по току интегральный (усредненный за все время электролиза) и парциальный (в определенный момент).
Выход по току характеризует эффективность использования по назначению тока электролиза. Для характеристики эффективности использования электроэнергии применяют показатели удельного расхода электроэнергии (W ф) и выхода по энергии (h э).
Под удельным расходом электроэнергии (W ф) понимают ее количество, затраченное на получение единицы массы продукта электролиза:
W ф=  . (7.12)
. (7.12)
Поскольку m ф = m т hт = qIth т, получаем
W ф=  =
=  . (7.13)
. (7.13)
Таким образом, величина фактического расхода электроэнергии определяется величинами рабочего напряжения, электрохимического эквивалента и выхода по току.
Выход по энергии (h э) равен отношению минимально возможного удельного расхода электроэнергии на получение данного целевого продукта W т к реальному или фактическому удельному расходу электроэнергии W ф:
h э =  . (7.14)
. (7.14)
По аналогии с уравнением (7.13) для минимально возможного удельного расхода энергии (U p = Е н.р, h т = 1) справедливо уравнение
W =  . (7.15)
. (7.15)
Подставив уравнения (7.13) и (7.15) в (7.14), имеем
h э = 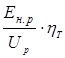 . (7.16)
. (7.16)
Видно, что эффективность использования электроэнергии определяется в равной степени как эффективностью использования тока (h т), так и рациональным использованием рабочего напряжения (Е н.р / U p). Это определяет значимость обоснованной минимизации всех составляющих рабочего напряжения (уравнение (7.8)), исключения, либо сведения к минимуму побочных электрохимических процессов (уравнение (7.11)).
Рассмотренные показатели представляют методологическую основу для исследования и совершенствования реальных электрохимических процессов.
Цинк является электроотрицательным металлом
(E oZn2+/Zn = - 0,76 В).
Однако вследствие очень низких токов обмена для выделения водорода на цинке
(i o = 1×10-11 А / см2 при i o,Zn = 1×10-5 А / см2)
кривые поляризации цинка идут значительно круче, чем водорода. Это дает возможность осаждать цинк из кислых растворов при повышенных i к с приемлемыми выходами по току.
Реакция на катоде (алюминий):
ZnSО4 + 2е = Zn + SO42- (7.17)
На аноде (Pb либо Pb-Ag) имеет место реакция выделения кислорода:
Н2О – 2е = 2Н+ +  О2 (7.18)
О2 (7.18)
Суммарная реакция при электролизе
ZnSО4 + Н2О == Zn +  О2 + H2SО4 (7.19)
О2 + H2SО4 (7.19)
В электролизеры непрерывно поступает нейтральный электролит, содержащий 100–150 г/л Zn2+, а из электролизеров вытекает кислый «отработанный» электролит, содержащий 40-60 г/л Zn2+ и 120-160 г/л H2SО4. При более низкой концентрации Zn2+ и более высокой концентрации серной кислоты выход по току резко снижается.
На процесс электролиза большое влияние оказывает температура. Ее повышение снижает быстрее перенапряжение выделения водорода, чем цинка, что отрицательно сказывается на выходе по току. На практике электролиз ведут при температурах не выше 35–40° С (применяют принудительное охлаждение). Выделяющийся кислород может приводить к аэрозольному распылению электролита (образование «сернокислотного тумана»). Для предотвращения этого явления в электролит вводят пенообразователи («мыльный корень»).
3. Аппаратура и методика эксперимента
Схема установки показана на рис.7.4.
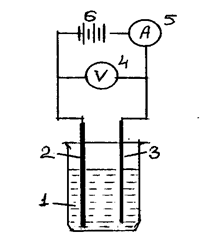
Рис.7.4.Схема установки:
1 – стеклянный стакан с электролитом; 2 – свинцовая пластина, служащая анодом; 3 – стальная либо алюминиевая пластина, служащая катодом; 4 – цифровой вольтметр; 5 – амперметр; 6 – источник постоянного тока.
В качестве электролита используется раствор, содержащий 2 моль / л ZnSO4, 0,1 моль / л H2SO4.
Величина напряжения разложения определяется методом снятия кривой «ток–напряжение» при последовательном увеличении силы тока на 1 мА. Вид I-V кривых показан на рис. 7.2, б.
Результаты опыта приведены в таблице 1
Таблица1. Результаты проведения опыта
| I, mA | E, B | I, mA | E, B | I, mA | E, B | I, mA | E, B |
| 2,482 | 2,74 | 2,859 | 2,965 | ||||
| 2,525 | 2,76 | 2,866 | 2,993 | ||||
| 2,562 | 2,78 | 2,875 | 3,021 | ||||
| 2,59 | 2,806 | 2,889 | 3,046 | ||||
| 2,62 | 2,82 | 2,904 | 3,044 | ||||
| 2,648 | 2,827 | 2,917 | 3,067 | ||||
| 2,68 | 2,84 | 2,93 | |||||
| 2,71 | 2,851 | 2,941 |
– 
Экстраполяция второго прямолинейного участка на ось абсцисс дает искомую величину напряжения разложения.
К этой же величине стремится во времени разность потенциалов электродов после отключения тока электролиза.
Величину обратной ЭДС определяют в момент отключения тока электролиза (первое показание цифрового вольтметра после отключения тока).
Среднее рабочее напряжение при определенной плотности тока определяют по показаниям цифрового вольтметра через каждую минуту электролиза при общей его продолжительности и определенной плотности тока 10 мин.
Массу цинка, выделившуюся при электролизе (m пр), находят по разности масс катода после и до электролиза, определяемых взвешиванием.
Массу цинка, которая должна была выделиться теоретически, рассчитывают по закону Фарадея (уравнение (7.10)).
Выход по току определяют по формуле (7.9). Зная выход по току по уравнениям (7.13) и (7.16), рассчитывают удельный расход электроэнергии и выход по энергии.
Результаты опытов и расчетов заносят в таблицу.
| Плотность тока, А / см2 | 0,02 | 0,04 | 0,06 |
| I,A | 0,06 | ||
| Ен.р., В | 2,87 | ||
| Еобр, В | 2,807 | ||
| Uр.ср, В | 2,907 | ||
| m факт., г | 0,0101 | ||
| mтеор, г | 
| ||
| hт, % | 
| ||
| W, кВт · ч / кг | 
| ||
| hэ, % | 
|
4. Выводы
В данной лабораторной работе мы рассматривали процесс электролитического получения цинка на аноде. В ходе проведения исследований мы получили экспериментальные данные ампер-вольтной характеристики рассматриваемого процесса. Анализируя данные этого графика, мы определили величину напряжения разложения, не прибегая к расчетам. Также, основываясь на показаниях приборов лабораторной установки и посчитав разницу между практически получившейся массы цинка, получившегося в результате электролиза и теоретической массой, мы получили величину выхода по току нашего процесса, а затем и удельный расход энергии и выход по энергии.