Общие положения по выполнению лабораторных работ
Цель лабораторных работ:
1) закрепить и углубить знания, полученные на лекциях и самостоятельных занятиях по взаимному превращению теплоты и работы, свойствам тел, участвующих в этих превращениях и используемых в тепловых машинах различного назначения;
2) приобрести навыки лабораторного эксперимента и использования измерительной аппаратуры;
3) научиться делать выводы и обобщения, составлять отчеты по результатам работы.
Непосредственно перед началом выполнения работы студенты обязаны пройти инструктаж по технике безопасности.
Перед выполнением каждой лабораторной работы студент обязан знать соответствующий теоретический материал.
Лабораторная работа выполняется бригадой из четырех-пяти человек.
После выполнения работы студенты составляют отчет о проделанной работе и защищают его у преподавателя (в этот же день).
Техника безопасности при выполнении работ
Включение лабораторных стендов допускается только с разрешения преподавателя.
Присутствие у лабораторного стенда разрешается только членам бригады, выполняющим данную лабораторную работу.
К выполнению лабораторной работы допускаются лица, ознакомившиеся с:
· устройством лабораторного стенда;
· возможными травмирующими факторами (производственными опасностями);
· последствиями от поражения электрическим током.
Категорически запрещается выполнять в лаборатории действия, которые могут повлечь за сбой несчастный случай.
При поражении электрическим током необходимо:
· вызвать к пострадавшему «скорую помощь» и поставить в известность преподавателя;
· по возможности отключить электропитание установки;
· освободить пострадавшего от действия электрического тока (откинуть сухим нетокопроводящим предметом электрический провод, оттащить пострадавшего за сухую одежду от электрического провода);
· при необходимости сделать искусственное дыхание (непрямой массаж сердца плюс искусственное дыхание изо рта в рот).
О любой неисправности установки или прибора, а также при возникновении несчастного случая следует немедленно поставить в известность преподавателя.
По окончании работы необходимо:
· выключить установку;
· сдать преподавателю все используемые приборы;
· привести рабочее место в порядок.
Покидать лабораторию без разрешения преподавателя запрещается. Лица, виновные в нарушении техники безопасности, несут ответственность в установленном порядке.
Оформление отчета о лабораторной работе
отчет о лабораторной работе оформляется на стандартных листах бумаги формата А4 (или в тетрадях).
Отчет должен в краткой форме раскрывать суть работы и содержать эскизы, диаграммы, схемы, уравнения. Письменный отчет должен быть грамотно оформлен в соответствии с установленными правилами.
Лабораторная работа № 1
Определение теплоемкости воздуха
Цель работы:
1) изучить понятие «теплоемкость»;
2) экспериментально определить изобарную теплоемкость воздуха.
Общетеоретические сведения
для того чтобы два различных рабочих тела с одинаковой массой нагреть до одинаковой температуры, нужно затратить различное количество теплоты.
Для вычисления количества теплоты в термодинамическом процессе используется понятие «теплоемкость ».
Теплоемкость C, Дж/К, – количество тепла Q, Дж, подведенное к телу для изменения температуры его на один градус, или бесконечно малое количество теплоты dQ, Дж, переданное телу при бесконечно малом изменении его состояния, чтобы изменить его температуру на dT:
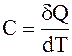 . (1.1)
. (1.1)
каждое тело обладает своей, присущей только этому телу теплоемкостью.
Если рабочее тело однородное, то к нему применяются понятия:
· удельной теплоёмкости с;
· объёмной теплоёмкости с|;
· мольной (молярной) теплоёмкости μс.
удельная теплоёмкость c, Дж/(кг×К), – количество тепла, Дж, подведенное к единице массы тела для изменения температуры на один градус или бесконечно малое количество удельной теплоты dq, Дж/кг, переданное телу при бесконечно малом изменении его состояния, чтобы изменить его температуру на dT:
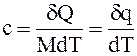 . (1.2)
. (1.2)
объёмная теплоёмкость с|, Дж/(м3×К), – теплоемкость, отнесенная к количеству газа, содержащегося в 1 м3 объема при нормальных условиях (t = 0 ºC = 273 К; рн = 760 мм рт. ст. = 1,013 бар = 101,325 кпа):
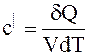 . (1.3)
. (1.3)
молярная теплоёмкость μс, Дж/(кмоль·К), – теплоемкость, отнесенная к одному киломолю:
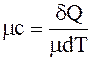 . (1.4)
. (1.4)
Взаимосвязь между теплоемкостями:
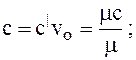 mс = с|mvo;
mс = с|mvo;  (1.5)
(1.5)
где vo – удельный объем, м3/кг;
mvo – объем 1 кмоля газа при нормальных физических условиях, м3/кмоль, mvo = 22,4.
В термодинамике различают истинную и среднюю теплоемкость.
средняя теплоемкость – отношение количества теплоты, сообщенной телу в интервале температур от Т1 до Т2, к конечному изменению температуры тела в данном процессе. Отношение количества удельной теплоты к соответствующему изменению температуры тела и является средней теплоемкостью:
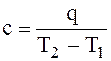 . (1.6)
. (1.6)
Из формулы (1.6) можно определить лишь то количество теплоты, которое в среднем сообщается при нагревании тела на один градус.
Если рассматривать малый участок процесса, в котором температура меняется на 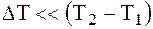 и взять предел отношения
и взять предел отношения 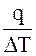 , то есть уменьшить рассматриваемый интервал температур до бесконечно малой величины, то величину предела можно назвать истинной теплоемкостью при данной температуре.
, то есть уменьшить рассматриваемый интервал температур до бесконечно малой величины, то величину предела можно назвать истинной теплоемкостью при данной температуре.
Таким образом, истинная теплоемкость – теплоемкость тела
при данной температуре, которая соответствует бесконечно малому изменению температуры тела.
Экспериментально установлено, что теплоемкость тела зависит от его температуры. Если температура тела в данном процессе меняется, теплоемкость на разных участках процесса неодинакова (рисунок 1).

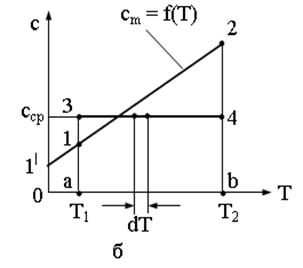
а – истинной теплоемкости;
б – истинной теплоемкости двухатомных газов
Рисунок 1 – Зависимость теплоемкости от температуры
Следовательно, если в некотором процессе 1-2
 , (1.7)
, (1.7)
то истинная теплоемкость в состоянии 1
 или
или 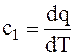 . (1.8)
. (1.8)
Из формул (1.6) и (1.8) следует, что
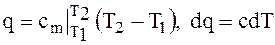 (1.9)
(1.9)
или 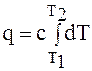 . (1.10)
. (1.10)
Как правило, теплоемкость возрастает с повышением температуры, причем эта зависимость изображается кривой, имеющий
различный характер для различных веществ.
Пусть кривая 1-2 (рисунок 1 а) отражает зависимость истинной теплоемкости от температуры – сm = f(Т). истинная теплоемкость тела измеряется при данной температуре ординатой любой точки на кривой 1-2. Количество теплоты q, необходимое для повышения температуры тела от Т1 до Т2, определяется по уравнению (1.10) и измеряется площадью a12b под кривой 1-2.
Эту же теплоту можно подсчитать по формуле
 , (1.11)
, (1.11)
отсюда 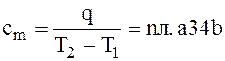 .
.
Следовательно, средняя теплоемкость для интервала температур от Т1 до Т2 может быть измерена высотой прямоугольника, равновеликого площади под кривой, сm = f(T).
Уравнение кривой 1-2 (рисунок 1 а) может быть записано в следующем виде:
с = а + bT + nT2. (1.13)
Это уравнение может быть использовано в качестве расчетного, если известны коэффициенты a, b, n, зависящие от природы газа, численное значение которых (для наиболее часто используемых рабочих тел) приводится в справочной литературе.
Для двухатомных газов при температуре не выше 1000 К зависимость теплоемкости от температуры с достаточной точностью можно полагать линейной (рисунок 1 б), тогда уравнение истинной теплоемкости
cm = a + bT, (1.13)
уравнение средней теплоемкости:
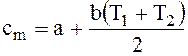 . (1.14)
. (1.14)
Более удобным и точным является использование таблиц теплоемкостей, приводимых в учебной и справочной литературе.
Однако в таблицах приводятся значения истинных теплоемкостей, а также средних теплоемкостей для интервалов температур от нуля до данной температуры (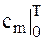 ). очевидно, чтобы привести в таблице значение
). очевидно, чтобы привести в таблице значение  для всех интервалов температур, размеры этой таблицы должны были бы быть бесконечно большими. для вычисления количества теплоты, участвующей в процессе изменения температуры от Т1 до Т2 по формуле (1.9), нужна средняя теплоемкость. Формулу для вычисления
для всех интервалов температур, размеры этой таблицы должны были бы быть бесконечно большими. для вычисления количества теплоты, участвующей в процессе изменения температуры от Т1 до Т2 по формуле (1.9), нужна средняя теплоемкость. Формулу для вычисления  по данным таблиц получаем исходя из следующих соображений. Теплота, сообщаемая телу в процессе изменения температуры от Т1 до Т2, равная
по данным таблиц получаем исходя из следующих соображений. Теплота, сообщаемая телу в процессе изменения температуры от Т1 до Т2, равная  , измеряется площадью а12b (рисунок 1 б), q = пл. а12b. но эта площадь может быть определена как разность площадей (1|12b0) и (1|1a0), то есть q = пл.a12b = пл.1|12b0 – пл.1|1a0. площадью 1|12b0 измеряется количество теплоты, сообщаемое телу в процессе изменения температуры от 0 до Т2, оно может быть вычислено по формуле
, измеряется площадью а12b (рисунок 1 б), q = пл. а12b. но эта площадь может быть определена как разность площадей (1|12b0) и (1|1a0), то есть q = пл.a12b = пл.1|12b0 – пл.1|1a0. площадью 1|12b0 измеряется количество теплоты, сообщаемое телу в процессе изменения температуры от 0 до Т2, оно может быть вычислено по формуле 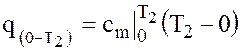 . площадь 1|1a0 равна теплоте
. площадь 1|1a0 равна теплоте 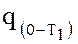 , определяемой по формуле
, определяемой по формуле 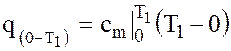 . (1.15)
. (1.15)
Следовательно,
 . (1.16)
. (1.16)
Отсюда, среднюю теплоемкость для данного интервала температур можно определить из выражения
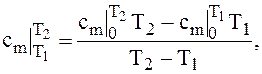 (1.17)
(1.17)
где  – средние значения теплоёмкостей, приводимые в таблицах в интервале температур от t1 до t2, К.
– средние значения теплоёмкостей, приводимые в таблицах в интервале температур от t1 до t2, К.
Изменение температуры при одном и том же количестве теплоты, сообщаемой рабочему телу, зависит от характера термодинамического процесса, следовательно, теплоемкость – функция процесса.
Из выражений (1.4) следует, что без подведения и отведения
теплоты с = 0. если dT = 0, то с = ± ∞. Значит, теплоемкость может меняться от + ∞ до – ∞.
В термодинамических расчетах большое значение имеет теплоемкость при постоянном давлении и постоянном объеме.
для термодинамических процессов, протекающих при постоянном давлении, удельную теплоемкость обозначают ср и называют изобарной теплоемкостью, при постоянном объёме удельную теплоемкость обозначают сv и называют изохорной теплоемкостью.
Изохорная удельная теплоемкость может быть найдена из формулы
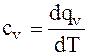 . (1.18)
. (1.18)
Из уравнения первого закона термодинамики dq = du + pdv, но при v = const pdv = 0, тогда dqv = du и  , отсюда следует
, отсюда следует
du = cvdT (1.19 а)
или после интегрирования
Δu = u2 – u1 = cv(T2 – T1). (1.19 б)
В выражении (1.19 а) сv – средняя удельная теплоемкость при постоянном объеме. индекс m здесь и далее опущен для простоты написания.
во всех формулах, описывающих процессы с конечным изменением температуры, например, q = сv (T2 – T1), участвует средняя удельная теплоемкость, в выражениях вида dq = cdT – истинная удельная теплоемкость.
Так как изменение внутренней энергии идеального газа зависит не от характера процесса, а от изменения температуры, то выведенная формула (1.19 а) является общей для определения изменения внутренней энергии во всех термодинамических процессах, в которых температура идеального газа изменяется от Т1 до Т2.
следовательно, изменение внутренней энергии идеального газа во всех термодинамических процессах равно произведению теплоемкости газа, определяемой при постоянном объеме, на разность температур в конце и начале данного термодинамического процесса.
Для расчета изобарной удельной теплоемкости ср необходимо использовать уравнение 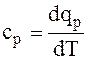 , учитывая, dqp = du + pdv.
, учитывая, dqp = du + pdv.
Подставив значение dqp в уравнение cр, получим
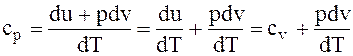 . (1.20)
. (1.20)
Обозначив
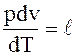 , (1.21)
, (1.21)
Имеем
ср = сv + ℓ. (1.22)
вычислим величину работы ℓ для идеального газа. уравнение состояния идеального газа при  :
:  .
.
Подставив значение Rdt в формулу (1.21) для работы ℓ, получим:
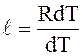 ; ℓ = R, (1.23)
; ℓ = R, (1.23)
где R – удельная работа газа, отнесенная к изменению его температуры при постоянном давлении, или газовая постоянная, Дж/(кг·К).
Следовательно, изобарная и изохорная удельные теплоемкости идеального газа связаны соотношением:
cp = cv + R. (1.24)
Уравнение (1.24) отражает закон Майера и является одним из основных в технической термодинамике идеальных газов.
Отношение 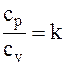 называют коэффициентом Пуассона, или показателем адиабаты.
называют коэффициентом Пуассона, или показателем адиабаты.