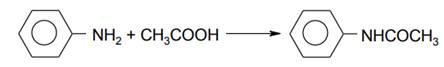АЦИЛИРОВАНИЕ
Ацилированием в органическом синтезе называют реакции введения ацильной группы (RCO-) в молекулы органических соединений путем замещения атома водорода. В более широком смысле ацилированием называют замещение любого атома или группы атомов на ацильную группу. В зависимости от типа атома, к которому присоединяется ацильная группа, различают С-ацилирование, N-ацилирование, О-ацилирование.
Реакции, при которых вводится ацетильная группа (СН3СО-), называются ацетилированием, бензоильная группа (С6Н5СО-) – бензоилированием и т.д. Наиболее распространенные ацилирующие агенты - хлорангидриды и ангидриды карбоновых кислот.
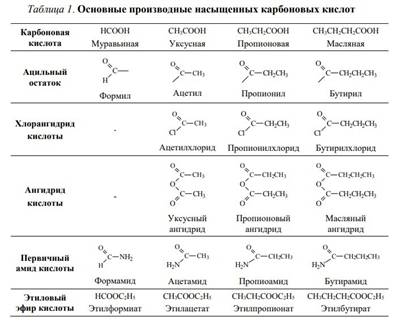
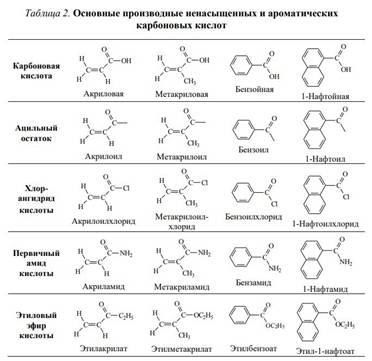 При помощи этих реакций могут быть синтезированы различные типы органических соединений, например, сложные эфиры, первичные, вторичные и третичные амиды карбоновых кислот, алифатические и ароматические кетоны, карбоциклические системы и многие другие органические соединения.
При помощи этих реакций могут быть синтезированы различные типы органических соединений, например, сложные эфиры, первичные, вторичные и третичные амиды карбоновых кислот, алифатические и ароматические кетоны, карбоциклические системы и многие другие органические соединения.
1. МЕТОДЫПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ КАРБОНОВЫХ КИСЛОТ (О-АЦИЛИРОВАНИЕ)
Спирты могут реагировать с образованием сложных эфиров не только с карбоновыми кислотами, но и с некоторыми функциональными производными кислот: хлорангидридами, ангидридами, сложными эфирами (RCOZ).
Чем больше отрицательный индукционный эффект (-Iэффект) и чем меньше положительный мезомерный эффект (+Мэффект) группы Z, тем больше будет частичный положительный dзаряд (+) на атоме углерода карбонильной группы и тем с R C O Z: +d -d большей скоростью протекает реакция ацилирования спиртов.
1.1. Реакции этерификации карбоновых кислот
Реакцией этерификации называется взаимодействие спиртов с карбоновыми кислотами, приводящее к образованию сложных эфиров (алкоголиз карбоновых кислот). В этой реакции молекула спирта выступает в роли нуклеофильного агента, атакующего электронодефицитный атом углерода карбонильной группы.
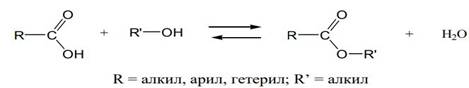
Реакция этерификации обратима и, следовательно, ограничена состоянием равновесия (обратная реакция называется гидролизом сложного эфира). В результате реакции образуется некоторое максимальное количество сложного эфира (которое всегда ниже теоретически вычисленного), и остаются не вступившие в реакцию кислота и спирт.
По мере накопления продуктов реакции скорость обратной реакции, в начале незначительная, постепенно возрастает; скорость прямой реакции постепенно снижается. Процесс происходит до наступления динамического равновесия.
Реакция этерификации протекает очень медленно. Основная причина заключается в том, что на атакуемом атоме углерода карбоксильной группы происходит уменьшение частичного положительного заряда вследствие влияния положительного мезомерного эффекта гидроксильной группы.
Для быстрейшего достижения равновесия реакцию этерификации проводят в присутствии катализаторов: минеральных кислот (серной или фосфорной кислот), сухого газообразного хлористого водорода, арилсульфокислот, которые протонируют атом кислорода карбоксильной группы и тем самым увеличивают частичный dположительный заряд (+) на атакуемом атоме углерода. Если при проведении реакции нежелательно присутствие кислот в реакционной смеси, то в качестве катализаторов используют ионообменные смолы (катиониты КУ-2, КУ-23).
Для изменения состояния равновесия и повышения выхода сложных эфиров (т.е. смещения равновесия вправо) применяют следующие способы:
· использование значительного избытка по сравнению со стехиометрическим количеством одного из исходных веществ. Обычно увеличивают концентрацию более доступного реагента (как правило, таким реагентом является спирт);
· удаление из реакционной смеси одного из образующихся веществ - сложного эфира или воды. Так, при получении низкокипящих сложных эфиров в ходе реакции отгоняют эфир из реакционной смеси (т.е. температура кипения сложного эфира должна быть ниже, чем у исходных веществ).
При получении высококипящих сложных эфиров удобнее отгонять воду в процессе реакции. Вода в этом случае отгоняется в виде азеотропной смеси с парами соответствующего спирта.
Если температуры кипения реагентов и продуктов близки, возможно применение инертного растворителя (бензол, толуол, тетрахлорметан и т.д.), дополнительно вводимого в реакционную смесь и образующего с водой низкокипящую азеотропную смесь. Это существенно облегчает удаление воды из смеси.
Минеральные кислоты (H2SO4, H3PO4) действуют не только каталитически в реакциях этерификации, но и как водоотнимающие средства, поэтому иногда их применяют в количествах, превышающих каталитические.
В настоящее время для реакции этерификации принят следующий механизм:
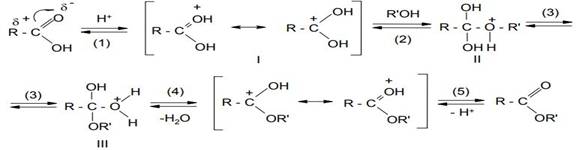
1. На первой стадии происходит электрофильное присоединение протона (от катализатора) по кратной С-О связи с образованием резонансно-стабилизированного карбениевого иона (I).
2. Далее катион (I) взаимодействует с молекулой спирта по неподеленной электронной паре атома кислорода, образуя интермедиат (II) (оксониевый ион).
3. Затем происходит перегруппировка оксониевого иона (II) в оксониевый ион (III).
4. Оксониевый ион (III) последовательно выделяет молекулу воды и протон, давая сложный эфир.
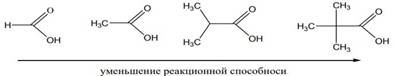
2 – ая стадия является самой медленной стадией процесса, поэтому скорость реакции в первую очередь определяется величиной частичного положительного заряда на атакуемом атоме углерода карбонильной группы, который зависит от характера радикала R в молекуле карбоновой кислоты. Более сильные карбоновые кислоты проявляют большую реакционную способность:
электронодонорные группы, связанные с карбоксильным атомом углерода, понижают частичный положительный заряд (по сравнению с зарядом в муравьиной кислоте) и тем самым препятствуют взаимодействию кислоты с нуклеофилом - молекулой спирта.
электроноакцепторные заместители, напротив, делают кислоту более реакционноспособной:
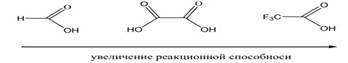
Достаточно сильные кислоты, такие, как муравьиная, трифторуксусная и щавелевая, быстро реагируют со спиртами даже без добавок минеральной кислоты в качестве катализатора.
Ароматические кислоты, особенно содержащие в ароматическом кольце электронодонорные заместители, взаимодействуют со спиртами значительно труднее и требуют больших количеств катализатора.
Существенную роль в реакции этерификации играют стерические (пространственные) эффекты, так как атом углерода карбонильной группы кислоты в интермедиате II переходит из плоской тригональной структуры (sp2 - гибридизация) в тетраэдрическую структуру (sp3 - гибридизация). С увеличением объёма связанных с карбоксилом углеводородных радикалов (R) и с повышением объёма радикала в спирте (R") скорость этерификации уменьшается.
Для прямой этерификации пространственно-затрудненных кислот используют метод, заключающийся в растворении карбоновой кислоты в 100%- ной серной кислоте с последующей обработкой раствора спиртом. При растворении кислот такого типа в безводной серной кислоте образуется ацилийкатион, который и участвует в реакции:
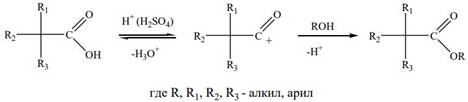
Аналогичные пространственные затруднения оказывают и алкильные группы, находящиеся рядом с гидроксильной группой в спиртах. По этой причине первичные спирты при прочих равных условиях образуют сложные эфиры легче, чем вторичные и, тем более, чем третичные спирты.
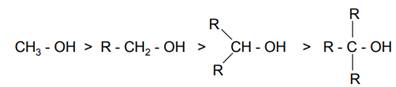
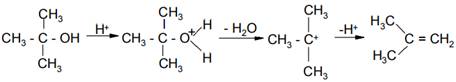
При проведении этерификации третичными спиртами следует также учитывать возможность изменения механизма реакции и протекания конкурирующей реакции элиминирования с образованием алкенов:
В лабораторной практике для получения сложных эфиров реакцией прямой этерификации используют следующие методики:
1. Связывание воды водоотнимающими средствами
Смешивают карбоновую кислоту и абсолютно безводный спирт (1:5), серную кислоту и кипятят без доступа влаги с обратным холодильником.
В случае вторичных спиртов смесь насыщают газообразным HCl и кипятят в 2 раза дольше.
2. Азеотропная этерификация
Смешивают карбоновую кислоту, абсолютный спирт (1:1,75), серную кислоту и растворитель (бензол, толуол, тетрахлометан и т.д.).
Реакционную смесь кипятят при перемешивании с обратным холодильником и насадкой Дина-Старка до прекращения выделения воды.
Азеотропный метод этерификации с кислотными катализаторами позволяет значительно снизить количество добавляемых минеральных кислот.
3. Ацилирование спиртов и фенолов хлорангидридами кислот
Этот метод синтеза сложных эфиров находит широкое применение, так как данная реакция необратима в отличие от реакции этерификации.
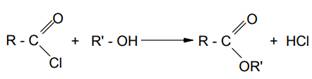
Выделяющийся в реакции хлористый водород либо выводят из сферы реакции, либо связывают его основанием (NaOH, N,N-диметиланилином, триэтиламином, пиридином).
Применение хлорангидридов в качестве ацилирующих агентов особенно важно в тех случаях, когда проводят ацилирование малореакционноспособных третичных спиртов и фенолов.
Следует особо отметить, что взаимодействие хлорангидридов с третичными спиртами может приводить к соответствующим третичным алкилхлоридам.
Наиболее простым случаем ацилирования является получение эфиров из хлорангидридов ароматических кислот и спиртов или фенолов.
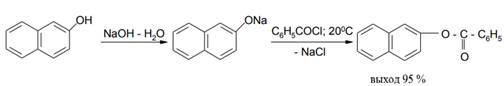 Наиболее общим методом ацилирования спиртов и фенолов является использование пиридина в качестве акцептора НСl, при этом реакцию можно проводить в избытке пиридина или в растворителях в бензоле или хлороформе:
Наиболее общим методом ацилирования спиртов и фенолов является использование пиридина в качестве акцептора НСl, при этом реакцию можно проводить в избытке пиридина или в растворителях в бензоле или хлороформе:
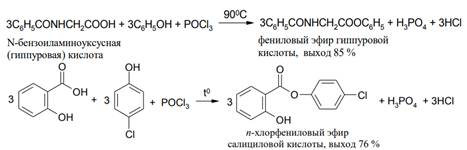
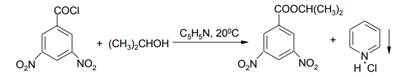 При получении сложных эфиров из фенолов вместо хлорангидридов можно применять смесь фенола, карбоновой кислоты и галогенирующего агента (РС15, РОСl3, РС13, SOCl2). Этот способ имеет особенно большое значение, когда хлорангидрид кислоты труднодоступен:
При получении сложных эфиров из фенолов вместо хлорангидридов можно применять смесь фенола, карбоновой кислоты и галогенирующего агента (РС15, РОСl3, РС13, SOCl2). Этот способ имеет особенно большое значение, когда хлорангидрид кислоты труднодоступен:
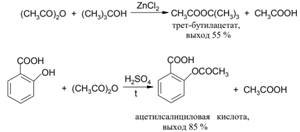
4. Ацилирование спиртов и фенолов ангидридами кислот

Эти реакции проводят как в отсутствие катализаторов, так и с применением таких катализаторов, как серная кислота, безводный хлорид цинка, п-толуолсульфокислота.
Механизм реакции такой же, как и при реакциях с хлорангидридами кислот, только при этом происходит отрыв карбоксилат-аниона, а не аниона хлора. Поскольку карбоксилат-анион в растворе менее термодинамически стабилен, чем анион галогена, то реакция ангидрида кислоты со спиртами несколько менее экзотермична, чем реакция соответствующего хлорангидрида:
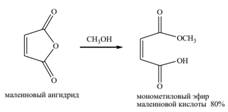
Циклические ангидриды дикарбоновых кислот раскрываются спиртом с образованием кислых эфиров:
5. Реакция переэтерификации (алкоголиз сложных эфиров)
При нагревании сложных эфиров со спиртами протекает реакция двойного обмена, именуемая переэтерификацией. На эту реакцию оказывают каталитическое действие как кислоты, так и основания:
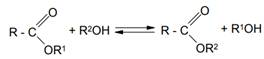
Для смещения равновесия в желаемом направлении применяют большой избыток спирта. 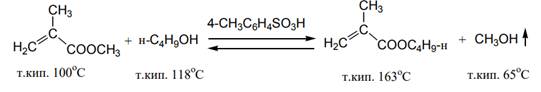
6. Алкоголиз эфиров b-кетокислот легко осуществляется при 90-100°С без катализатора.
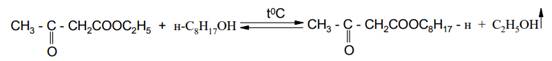
Так удается провести обменное замещение первичного спирта другим первичным или вторичным спиртом с более высокой температурой кипения, однако для получения сложных эфиров из третичных спиртов этот способ не пригоден. Эфиры третичных спиртов получают другим способом - взаимной переэтерификацией двух различных эфиров карбоновых кислот, например эфира муравьиной кислоты и какой-либо другой кислоты:
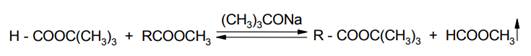
МЕТОДЫПОЛУЧЕНИЯ АМИДОВ КАРБОНОВЫХ КИСЛОТ (N-АЦИЛИРОВАНИЕ)
Взаимодействие карбоновых кислот с аминами приводит к образованию амидов.
Реакцию проводят при продолжительном нагревании эквимолярных количеств кислоты и амина. При этом происходит выделение воды из первоначально образующейся соли амина.
Анилин ацетилируется уксусной кислотой при температуре 120-1400С с образованием ацетанилида с выходом до 80%: