Тема 1.5. «Растворы. ТЭД»Требования к знаниям и умениям студентов
| ЗНАТЬ | УМЕТЬ |
| 1.знать определения важнейших понятий (раствор, истинные растворы, растворение, растворимость, насыщенный раствор, концентрация растворенного вещества, электролиты, электролитическая диссоциация, степень диссоциации) | 1.уметь правильно использовать понятия при ответах. |
| 2.знать физико-химический механизм процесса растворения (разрушение решетки, гидратация, диффузия, кристаллизация), условия, которые влияют на процесс растворения. | 2.уметь объяснять влияние условий (температура, перемешивание) на скорость процесса растворения |
| 3. знать понятие насыщенного раствора, как состояние равновесия системы и меру растворимости вещества, влияние на растворимость веществ их природы, температуры и давления. | 3. уметь определять влияние природы веществ, температуры и давления на величину растворимости; уметь рассчитывать содержание вещества в насыщенном растворе и готовить его |
| 4. знать способы выражения содержания растворенного вещества в растворе (массовая доля вещества, молярная концентрация) | Уметь делать расчеты по формулам  и с =
и с =  и готовить растворы с определенным содержанием растворенного вещества и готовить растворы с определенным содержанием растворенного вещества
|
| 5. знать общие свойства растворов (диффузия, осмос, осмотическое давление, изотонические и гипертонические растворы, изменение температуры кипения и замерзания…) и их зависимость от концентрации раствора | 4. определять направление диффузии и осмоса, рассчитывать величину осмотического давления в растворе (закон Вант-Гоффа), изменение температуры замерзания и кипения (закон Рауля) |
| 6. знать основные понятия и положения ТЭД (электролиты и неэлектролиты, процесс диссоциации, степень диссоциации, сильные и слабые электролиты, константа диссоциации) | 3. уметь определять принадлежность вещества к электролитам, объяснять зависимость степени диссоциации электролитов от природы веществ и концентрации растворов, сдвиг равновесия в растворе слабого электролита при изменении концентрации одноименного иона |
| 7. знать, как диссоциируют соли, основания и кислоты (понятие обратимой диссоциации, понятие ступенчатой диссоциации) | 4. уметь записывать уравнения диссоциации электролитов, пояснять их с помощью константы диссоциации и степени диссоциации |
| 8. знать алгоритм написания ионных уравнений, условия при которых протекают реакции ионного обмена | 5. уметь записывать полные и сокращенные ионные уравнения, делать выводы о полноте протекания реакций ионного обмена |
| 9.знать протонную теорию кислот и оснований, понятия сопряженных кислот и оснований, протолитических реакциях (диссоциация, нейтрализация, гидролиз) | 6. иметь представление о воде как о слабом амфотерном электролите, знать понятие ионного произведения, водородного показателя, кислотность среды |
| 10. иметь представление о воде как о слабом амфотерном электролите, знать понятие ионного произведения, водородного показателя, кислотность среды | 7.уметь объяснять проявления водой свойств слабого амфотерного электролита, записывать уравнение диссоциации, определять кислотность среды с помощью универсального индикатора и рН-метра и делать расчеты с помощью формул Kw= [H+]·[OH-] и pH= -lg[H+] |
Теория растворов.
План.
1.Роль растворов и воды в жизнедеятельностиорганизмов и в медицине.
2. Механизм процесса растворения. Термодинамические процессы при растворении.
3. Растворимость. Зависимость растворимости веществ в жидкостях от природы вещества, от температуры.
4. Зависимость растворимости газов от давления. Закон Генри – Дальтона. Кессонная и горная болезнь. Влияние электролитов на растворимость газов.
5. Способы выражения концентрации растворов. Массовая доля вещества в растворе. Молярная концентрация. Нормальная концентрация. Моляльная концентрация.
6. Коллигативные свойства растворов.
1. Понятие о растворах.
Вода уникальна по своим свойствам и именно этим обусловлена ее роль в процессах жизнедеятельности. На Земле основные механизмы химических реакций складывались в процессе длительной эволюции с непосредственным участием воды. Все живые клетки организмов состоят на 60-80% из воды. Из 70 кг веса человека приблизительно 45-50 кг это вода, из них около 5 л это плазма крови, около 10 л – лимфа и внеклеточная жидкость, остальное – внутриклеточная вода.Все биологические процессы, происходящие в живых организмах, протекают в растворах. В фармацевтической промышленности производство основной массы лекарств тоже осуществляется в растворах. Следовательно, прогресс таких наук как биология, медицина, фармация тесно связано с учением о растворах.
Растворы — это смеси. Но смеси особые. Раствор —термодинамически устойчивая система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия, равномерно распределенных в объеме всей системы. Т.е. процесс растворения это не простое распределения молекул одного вещества среди молекул другого. Растворение -это сложный физико-химический процесс взаимодействия растворенного вещества с растворителем. Сложный, потому что состоит обычно из нескольких процессов: разрушения кристаллической решетки растворяемого вещества, гидратации, диффузии и кристаллизации растворенного вещества.
Вообще растворы бывают и жидкие, и газообразные (воздух), и твердые (сплавы). Но обычно, когда говорят о растворах, имеют в виду именно жидкие растворы, а из жидких – водные растворы. Хотя в принципе растворителем может быть и другое вещество, например, спирт или бензол… Обычно растворителем считают вещество, которое находится в том же агрегатном состоянии, что и весь раствор и преобладает количественно. Исключение – вода.
2. Растворы бывают истинные и коллоидные. Рассмотрим сначала истинные растворы. Истинные растворы - гомогенные (однородные) смеси, они прозрачные, т.к. размеры частиц растворенного вещества меньше длины световой волны, истинные растворы неограниченно устойчивы во времени;
 Как происходит процесс растворения?
Как происходит процесс растворения?
Когда кристалл вещества вносят в жидкость, в которой он может растворяться, от его поверхности отрываются отдельные частицы. Это происходит благодаря собственным колебательным движениям частиц веществ и притяжением со стороны молекул растворителя. Идет разрушение кристаллической решетки. Это взаимодействие растворенного вещества с растворителем может приводить к образованию устойчивых соединений – гидратов. Благодаря диффузии они равномерно распределяются по всему объему растворителя. Диффузия – самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентраций в разных частях системы в результате теплового движения частиц растворенного вещества и растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно с процессом растворения не проходил обратный процесс – кристаллизация. Перешедшие в раствор частицы, ударяясь о поверхность еще  нерастворенного вещества, снова притягиваются к нему и входят в состав кристаллов.
нерастворенного вещества, снова притягиваются к нему и входят в состав кристаллов.
Т.е. растворение процесс обратимый, основными процессами в этом сложном явлении является разрушение решетки и кристаллизация. Когда скорости этих двух процессов станут равными, т.е. установится равновесие, полученный раствор назовут насыщенным. Т.е. насыщенным называют раствор, в котором содержится максимально возможное при данных условиях количество растворенного вещества и больше там это вещество не растворяется. Если в системе процесс растворения преобладаетнад процессом кристаллизации– значит это ненасыщенный раствор. Если кристаллизация происходит быстрее растворения – значит раствор пересыщенный.
Рассмотрим процесс растворения с точки зрения термодинамики. Большинство твердых веществ растворяются в жидкостях с поглощением теплоты. Почему? При растворении кристаллов происходит их разрушение, разрыв химических связей, это требует затраты энергии, иногда очень значительной (например, растворение нитрата аммония). Но иногда при растворении твердых веществ наблюдается выделение тепла (например, растворение гидроксида натрия). Общий термический эффект процесса растворения твердого вещества зависит от соотношения двух факторов: теплового эффекта разрушения решетки (эндотермический процесс) и теплового эффекта гидратации (экзотермический процесс). Если отсутствует кристаллическая решетка (т.е. вещество в жидком или газообразном состоянии), то растворение обычно сопровождается выделением тепла.
Диффузия процесс физический и не сопровождается тепловым эффектом, а процессом кристаллизации в начале растворения, т.е. в ненасыщенном разбавленном растворе можно пренебречь, его скорость незначительна и тепловой эффект тоже.
 3. Растворимость – это способность вещества растворяться при данных условиях в данном растворителе. Мерой растворимости служит концентрация его насыщенного раствора, которая выражается обычно в г вещества на 100 г растворителя. Качественная характеристика растворимости дается в таблице растворимости. Обычно растворимыми считают вещества, концентрация насыщенных растворов которых больше 1 г на 100 г воды. Если эта цифра меньше 0,01 г, то говорят, что вещество нерастворимо.
3. Растворимость – это способность вещества растворяться при данных условиях в данном растворителе. Мерой растворимости служит концентрация его насыщенного раствора, которая выражается обычно в г вещества на 100 г растворителя. Качественная характеристика растворимости дается в таблице растворимости. Обычно растворимыми считают вещества, концентрация насыщенных растворов которых больше 1 г на 100 г воды. Если эта цифра меньше 0,01 г, то говорят, что вещество нерастворимо.
Для более точной количественной характеристики используют понятие«произведение растворимости» ионов насыщенного раствора малорастворимых соединений. Это величина константы равновесия процесса растворения. Например, при растворении гидроксида кальция устанавливается в растворе равновесие между кристаллическим веществом и ионами в растворе.
Са(ОН)2(кристалл)↔Са2+(раствор) + 2ОН-(раствор)
Крс= [Ca2+] [OH- ] = 10-2Она называется «произведение растворимости) – ПР(Ca(OH)2). Для Сu(OH)2ПР= 10-20
Величина растворимости зависит, прежде всего, от природы вещества и растворителя. «Золотое правило растворимости» - «подобное в подобном». Т.е. если частицы растворенного вещества и растворителя похожи по строению (прежде всего по типу химической связи), то вещества хорошо растворяются друг в друге (смешиваются неограниченно). Если между веществами слабое межмолекулярное и химическое взаимодействие, то растворимость незначительная. Например: неполярные молекулы N2, O2, H2 «неподобны», т.е. непохожи на полярные молекулы воды и в ней не растворяются. Полярные молекулы веществ CO2, NH3,SO2 и полярные молекулы воды хорошо взаимодействуют друг с другом, поэтому их растворимость весьма высокая.
Растворимость зависит от температуры. По правилу Ле-Шателье равновесие при эндотермическом растворении при повышении температуры будет смещаться в сторону растворения, и наоборот (см. выше – термический эффект растворения). Поэтому растворимость большинства твердых веществ увеличивается с повышением температуры, а растворимость газов – уменьшается (см. таблица зависимости растворимости от температуры). При растворении одной жидкости в другой могут быть варианты: 1- растворяются неограниченно, смешиваются в любых пропорциях (если они похожи по строению – «золотое» правило), 2 – взаимно растворяются до известного предела (например, в системе сложный эфир – вода образуется насыщенный раствор воды в эфире и насыщенный раствор эфира в воде). В большинстве случаев с повышением температуры растворимость жидкости в другой жидкости будет увеличиваться за счет ускорения теплового движения, и, в конце концов, жидкости смешаются неограниченно, раздел фаз исчезнет (например, растворение фенола). Такая температура, при которой исчезает граница раздела между разными по природе жидкостями называется критической. Если в систему из двух несмешивающихся жидкостей ввести третье вещество, способное растворяться в каждой из них, то это вещество будет распределяться между обеими жидкостями пропорционально свое растворимости в них, т.е. так, что отношение его концентраций в этих растворителях при постоянной температуре останется постоянной, независимо от общего количества вещества. Это явление используется при получении лекарств (экстракция), наблюдается при явлении проникновения веществ через биомембраны и т.д.
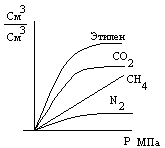 4. Растворимость зависит и от давления – но только для газов! Давно замечено, что при растворении веществ общий объем раствора меньше, чем сумма объемов исходных веществ. Но только при растворении газов общий объем уменьшается очень значительно. Значит если процесс растворения газов проводить при постоянном объеме, то в системе сильно уменьшается давление. И по правилу Ле-Шателье при повышении давления этот процесс будет ускоряться, т.е. растворимость газов будет увеличиваться.
4. Растворимость зависит и от давления – но только для газов! Давно замечено, что при растворении веществ общий объем раствора меньше, чем сумма объемов исходных веществ. Но только при растворении газов общий объем уменьшается очень значительно. Значит если процесс растворения газов проводить при постоянном объеме, то в системе сильно уменьшается давление. И по правилу Ле-Шателье при повышении давления этот процесс будет ускоряться, т.е. растворимость газов будет увеличиваться.
Закон Генри: Масса газа, растворяющаяся при постоянной температуре в данном объеме жидкости, прямопропорциональна парциальному давлению этого газа: с=k·p, с- молярная доля газа, р- парциальное давление, к- константа. (Парциальное давление- это часть общего давления, обусловленная именно этим газом. Закон Дальтона: р = р1 + р2 + р3 +…, т.е. общее давление равно сумме парциальных давлений всех газов, находящихся в смеси). Эти законы позволяют объяснить поступление газов из воздуха в кровь и обратно.
Горная болезнь – при подъеме на большую высоту парциальное давление кислорода падает, следовательно, уменьшается содержание его в крови. Это ведет к учащению дыхания, сердцебиению и т.д.
Кессонная болезнь – при опускании на глубину давление увеличивается и увеличивается растворимость газов в крови. При быстром подъеме эта растворимость быстро уменьшается, и газы выделяются в виде пузырьков, закупоривая сосуды.
| H2 | O2 | N2 | CO2 | НСl | CH4 | |
| 00C | 2,15 | 4,9 | 2,35 | 5,5 | ||
| 200C | 1,8 | 3,1 | 1,5 | 3,3 |
Растворимость газов в водных растворах зависит от присутствия в них электролитов.Сеченов установил, что растворимость газов в растворах электролитов меньше, чем в чистом растворителе, т.к. часть воды в растворе тратиться на гидратацию электролита, связывается, следовательно, реально свободной воды в растворе меньше, чем в чистом растворителе.
5. Важнейшей характеристикой раствора является его качественный и количественный состав (т.е. какие компоненты и сколько). Существует несколько способов выражения количественного состава раствора.
Массовая доля вещества в растворе (т.н. «процентная концентрация») не является собственно «концентрацией», т.к. ничего не говорит нам о числе частиц в единице объема раствора. 
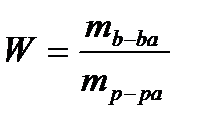
Иначе говоря, массовая доля вещества равна числу граммов этого вещества содержащихся в 1 г раствора. Массовую долю можно выражать в процентах (для этого ее умножают на 100), и тогда эта величина равна числу граммов вещества содержащихся в 100 г раствора.
Определим, например:
№1 Какую массу соли и воды надо взять для приготовления 200 г 5% раствора соли?
5%=0,05 mb-ba= mp-paW, 200г ∙0,05=10г соли, т.е. надо взвесить 10 г соли; раствор состоит из соли и воды, поэтому массу воды найдем: 200-10=190 г Но воду не взвешивают. Ее плотность равна 1 г/мл, поэтому VH2O= m/1= m; Надо взять 190 мл воды и добавить ее в стаканчик со взвешенной солью.
№2 Сколько воды надо добавить, чтобы из 500г 10% раствора перекиси водорода приготовить 3% раствор?
3%=0,03 10%=0,1 в первом растворе 500∙ 0,1=50г перекиси, эти 50 г составляют 0,03 от второго раствора, его m= 50/0,03= 1667 г, значит надо добавить 1667-500=1167 г воды.
Молярная концентрация или Молярность раствора (c) – число молей растворенного вещества в 1 л раствора. Т.е. в 1л 1М раствора содержится 1 моль вещества. С = ν/V
Например:
№3 Как приготовить 500 мл 0,1 М раствор гидроксида натрия?
М(NaOH)=40 г/моль  0,1моль/л∙ 40 г/моль = 4 г щелочи надо для приготовления 1 л раствора, а нам надо 500 мл, т.е. надо взять 4∙ 500: 1000 = 2 г. Надо взвесить эти 2 г щелочи, поместить в мерную колбу на 50 мл и долить дистилированой водой до метки.
0,1моль/л∙ 40 г/моль = 4 г щелочи надо для приготовления 1 л раствора, а нам надо 500 мл, т.е. надо взять 4∙ 500: 1000 = 2 г. Надо взвесить эти 2 г щелочи, поместить в мерную колбу на 50 мл и долить дистилированой водой до метки.
№4 Как из 0, 1М сделать 0, 01М раствор?
Чтобы молярность уменьшилась в 10 раз (а количество вещества менять нельзя), надо увеличить объем раствора в 10 раз.
Нормальность - число грамм-эквивалентов растворенного вещества в 1 л раствора. Грамм-эквивалент - число граммов химического элемента или соединения, равное массе его эквивалента химического. Грамм-эквивалент химического элемента численно равен частному от деления атомной массы элемента на его валентность: например, Грамм-эквивалент железа (атомная масса 55,847) 2-валентного равен 27,92 г, а 3-валентного 18,62 г. Грамм-эквивалент кислоты — количество её в граммах, содержащее один Грамм-эквивалент водорода, способного замещаться металлом с образованием соли. Т.е. надо молекулярную массу кислоты разделить на число атомов водорода, участвующих в реакции. Грамм-эквивалент основания — количество его в граммах, необходимое для полного взаимодействия с одним Грамм-эквивалент кислоты. Грамм-эквивалент соли — количество её в граммах, содержащее один Грамм-эквивалент металла. Понятие Грамм-эквивалент широко применяется в объёмном анализе (титровании).
Титр- число г растворенного вещества в 1 мл раствора.
Моляльность – число молей растворенного вещества в 1000 г растворителя.Для воды 1000 г – это 1 литр. Поэтому для водных растворов моляльность - это число молей вещества в 1 литре воды.
Свойства растворов, которые зависят от числа частиц в растворе, т.е. от концентрации, но не зависят от природы вещества, называются коллигативными. Это диффузия, осмотическое давление, упругость пара над растворителем, температура кипения и замерзания.
Диффузия – это самопроизвольный процесс выравнивания концентрации растворенного вещества в результате хаотического теплового движения частиц раствора.
 Если к концентрированному раствору соли добавить воду, то молекулы соли будут проникать в воду, а молекулы воды в раствор соли, пока концентрация соли и воды по всему объему не станет одинаковой. Это и есть диффузия. Скорость диффузии будет зависеть от градиента концентрации (градиентом называют изменение концентрации
Если к концентрированному раствору соли добавить воду, то молекулы соли будут проникать в воду, а молекулы воды в раствор соли, пока концентрация соли и воды по всему объему не станет одинаковой. Это и есть диффузия. Скорость диффузии будет зависеть от градиента концентрации (градиентом называют изменение концентрации  на единицу длины
на единицу длины  в направлении диффузии, т.е. разница концентраций в двух точках). Чем больше разница концентраций, тем больше скорость диффузии.
в направлении диффузии, т.е. разница концентраций в двух точках). Чем больше разница концентраций, тем больше скорость диффузии.
Перемещение веществ в клетку и из нее осуществляется разными способами. Один из них – диффузия.
Но проникновение через мембрану ионов зависит не только от концентрационного, но и от электрического градиента мембраны. В связи с этим перенос ионов может осуществляться в направлении, противоположном концентрационному градиенту, при наличии противоположного направленного электрического градиента. Многие клеточные мембраны обладают свойством полупроницаемости, т.е. могут пропускать одни частицы и задерживать другие. Таким свойством обладают не только растительные и животные мембраны, но и искусственные (коллодий, целлофан и т.д.)
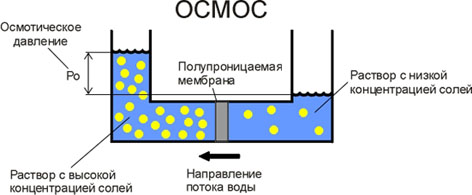 Осмос – явление самопроизвольного перехода растворителя в раствор, отделенный от него полупроницаемой мембраной (целлофан, коллодий). Можно сказать, что осмос - это односторонняя диффузия, т.е. одни молекулы (растворителя) могут свободно передвигаться по всему объему раствора, а другие могут находиться только с одной стороны мембраны. Частицы растворителя двигаются из области, где их больше (из чистого растворителя), туда, где их меньше (в раствор). Т.е. это диффузия, но не растворенного вещества, а растворителя.
Осмос – явление самопроизвольного перехода растворителя в раствор, отделенный от него полупроницаемой мембраной (целлофан, коллодий). Можно сказать, что осмос - это односторонняя диффузия, т.е. одни молекулы (растворителя) могут свободно передвигаться по всему объему раствора, а другие могут находиться только с одной стороны мембраны. Частицы растворителя двигаются из области, где их больше (из чистого растворителя), туда, где их меньше (в раствор). Т.е. это диффузия, но не растворенного вещества, а растворителя.
Сила, заставляющая растворитель переходить через полупроницаемую перегородку в раствор, имеет ту же природу, что и сила, заставляющая газ из сосуда, где он находился при большем давлении, переходить в сосуд с меньшим давлением. Вот почему для жидких растворов эту силу называют осмотическим давлением. Осмос не является свойством ни растворителя, ни растворенного вещества; это явление, которое возникает в системе, состоящей из 2-х растворов с различными концентрациями, разделенных полупроницаемой мембраной. Чем больше разница концентраций в растворах, тем выше осмотическое давление.
Величину осмотического давления определяют по закону Вант-Гоффа P=CRT, где P- осмотическое давление, C – молярная концентрация, R – 8,13  ,T – температура Кельвина.
,T – температура Кельвина.
Осмотическое давление в растворах электролитов может быть очень большим:
-морская вода (3,5% раствор солей) - 28 атм.
- вода озера Сиваш- 200 атм.
-6% р-р сахара – 0,6 атм.
- плазма крови человека 7,7 атм
Т.е. осмотическое давление крови у человека достаточно велико (см. выше). Такое большое значение давления обусловлено наличием в крови большого числа ионов и молекул. Часть осмотического давления крови, обусловленная белками, называется онкотическим давлением. Оно составляет всего 0,5% от общего осмотического давления крови. Но изменение онкотического давления очень важный параметр гомеостаза, потому что его изменение говорит об изменении концентрации белков в крови.
Изотоническими называют растворы, которые имеют одинаковое осмотическое давление, в этих растворах одинаковая молярная концентрация частиц. Гипотоническим называют раствор, в котором осмотическое давление более низкое, а гипертоническим – более высокое чем в растворе сравнения. Если полупроницаемая мембрана разделяет изотонические растворы, то осмотическое давление отсутствует; если разное давление, то растворитель начинает проходить через мембрану из раствора с низким осмотическим давлением в раствор с более высоким давлением; если разность давлений велика, то возможно повреждение мембраны. При погружении клетки в гипертонический раствор наблюдается плазмолиз, клетка сжимается, уменьшается в объеме. В гипотонических растворах объем клетки увеличивается, и она может лопнуть.
Процесс осмоса в живых организмах сильно зависит от природы мембран. В одних случаях она проницаема только для молекул растворителя (воды), в других – через нее могут проходить молекулы определенных веществ, либо растворяющихся в ее липидах, либо взаимодействующих с ее компонентами. Причем проницаемость мембраны может регулироваться. Например, проницаемость почечной мембраны зависит от концентрации антидиуретического гормона (АДГ).
В норме внутри клетки всегда ионов больше, чем снаружи. Этим объясняется повышенное осмотическое давление клетки по сравнению с внеклеточной жидкостью. Это способствует поддержанию тургора клетки. При патологии, например, при понижении содержания белков в крови (голодание, болезнь почек…), уменьшается онкотическое давление, нарушается соответствие между давлениями внутри клетки и вне ее, вода переходит в клетку, вызывая отеки.
В медицине применяются различные по составу физиологические растворы, изотоничные плазме крови. Их вводят при обезвоживании или потери крови. Ими обрабатывают раны. Гипертонические растворы используют при отеках и внутренних кровотечениях, а так же для лечения гнойных ран.
Над поверхностью жидкости в результате процесса испарения (диффузия) всегда есть какое –то количество молекул этой жидкости. Давление пара жидкости над раствором зависит от температуры и природы жидкости. Кипение жидкости начинается тогда, когда давление паров над жидкостью станет равно внешнему давлению. Изучая давление пара растворителя над разбавленными растворами нелетучих веществ, Рауль обнаружил, что оно пропорционально молярной доле растворителя. Т.е. давление пара над раствором меньше, чем над чистым растворителем. Это происходит потому, что часть поверхности жидкости в растворе занята молекулами нелетучего растворенного соединения, и процесс испарения жидкости затруднен.Снижение давления пара приводит к необходимости нагревать раствор до более высокой температуры, чтобы достигнуть давления, при которой закипает чистая жидкость. Т.е. растворы нелетучих веществ кипят при более высоких температурах, чем чистые растворители. Причем  , где Е – эбуллиоскопическая константа, а m- моляльная концентрация, которую выражают
, где Е – эбуллиоскопическая константа, а m- моляльная концентрация, которую выражают  , где а –масса растворенного вещества, М – его молекулярная масса, b – масса растворителя.
, где а –масса растворенного вещества, М – его молекулярная масса, b – масса растворителя.
Аналогично, растворы нелетучих веществ замерзает при более низких температурах, чем чистые растворители. Эта зависимость выражается законом Рауля  , где К- криоскопическая константа.
, где К- криоскопическая константа.
Криоскопия – метод, который позволяет определять концентрацию раствора или молекулярную массу вещества по изменению температуры замерзания. Эбуллиоскопия - по изменению температуры кипения. Первый способ более употребителен, потому что легче измерить температуру замерзания раствора и при низких температурах не происходит изменений в структуре растворенных веществ и растворителя. В биологических и медицинских исследованиях понижение температуры замерзания растворов часто называют депрессией растворов. Измерение депрессии биологических жидкостей позволяет рассчитывать «осмотическую концентрацию», т.е. суммарную концентрацию всех частиц в растворе. Для электролитов надо учитывать процесс диссоциации.
Упражнения.
№1 Выпишите в тетрадь основные понятия теории растворов и выучите их.
№2 Что происходит при растворении твердого вещества в жидкости? Почему растворение называют сложным физико-химическим процессом?
№3 Что такое «насыщенный раствор»? Как получить насыщенный раствор? Как из насыщенного раствора получить ненасыщенный?
№4 Что такое растворимость вещества? От чего она зависит?
№5 В чем суть «золотого правила растворимости»? Приведите примеры.
№6 Как зависит растворимость от температуры?Как растворимость зависит от давления?
№7*Приготовьте насыщенный раствор соли. Отделите полученный раствор от кристаллов соли. Медленно охладите раствор, внеся в него затравку для кристаллизации. Сфотографируйте полученный кристалл и опишите как вы его получили (формат А-4).
№8 Пользуясь графиком определите растворимость нитрата калия при 40оС. Сколько г этой соли можно растворить в 1 л воды при 40оС? Что произойдет, если 1 л такого раствора охладить до 20 оС?
№9 Пользуясь графиком определите растворимость в воде кислорода при 20оС. Какой объем кислорода может растворится в 0,5 л воды? Что произойдет, если нагреть эту воду до 40оС?
№10 Что такое осмос? Осмотическое давление? От чего зависит величина осмотического давления?
№11 В каком растворе осмотическое давление больше: А) в 0,1М растворе сахара или 0,1М растворе поваренной соли? Б) в 1% растворебелка или в 1% растворе глюкозы?
№12 Что такое изотонические растворы? Почему для внутривенного введения используют изотонические растворы?
№13 Как приготовить 200 мл 0,2М раствора гидроксида калия?
№14 Как приготовить 200 г 3% раствора соды?
№15 Как приготовить 1% раствор марганцовки из 500 г 5% раствора?
Лабораторные опыты.
Оборудование: весы с разновесами, стеклянные 3 стакана на 50 мл, 3 колбы 500 мл, мерный цилиндр, мерная колба на 200 мл, воронка, фильтр
Реактивы: нитрат натрия.
ТБ: стекло
1. Приготовление насыщенного раствора нитрата натрия.
По графику зависимости растворимости твердых веществ от температуры (см. УМП) найдите, сколько соли можно растворить в 100 г воды при температуре 40оС. Рассчитайте, сколько соли может раствориться в 50 мл воды. Взвесьте соли на 10 г больше, чем рассчитали. Отмерьте мерным цилиндром 50 мл воды и налейте в колбу.Всыпьте половину взвешенной соли в теплую воду (по частям, перемешивая). Что наблюдаете? Какой раствор вы получили? Высыпьте вторую половину соли и перемешайте. Что наблюдаете? Почему? Полученный раствор отфильтруйте через воронку в чистый стаканчик и поставьте его в кристаллизатор с холодной водой (со льдом). Какой раствор получится при охлаждении? Что наблюдаете? Почему? (Если раствор остыл, а изменений нет, потрите стеклянной палочкой о стенку стакана или бросьте туда маленький кристалл KNO3). Опишите свои действия, наблюдения и расчеты.
2. Приготовление 200 мл 0,01 М раствора нитрата натрия.
Рассчитайте массу соли, которую необходимо взять для приготовления этого раствора. Взвесьте нужную массу соли. Перенесите с помощью воронки эту соль в мерную колбу на 200 мл. Налейте в колбу воды приблизительно на 1/3 и перемешайте до полного растворения. Смойте водой остатки соли из стаканчика для взвешивания и полученный раствор вылейте в колбу. Добавьте в колбу воду до метки. Будьте внимательны, последние порции добавляйте по каплям.
3. Приготовление 200 г 3% раствора нитрата натрия
Рассчитайте массу соли и воды, необходимые для приготовления раствора. Взвесьте нужное количество соли в специальной посуде. Высыпьте соль в колбу. Отмерьте нужный объем воды мерным цилиндром и вылейте эту воду в колбу с солью, предварительно ополоснув ею посуду для взвешивания. Перемешайте полученную смесь до полного растворения соли.