Работа 7.1. ИЗМЕРЕНИЕ РАВНОВЕСНЫХ ПОТЕНЦИАЛОВ
1. Цель работы
Работа посвящена экспериментальному определению величин равновесных потенциалов меди в сульфатных электролитах, содержащих различное количество сульфата меди и серной кислоты, установлению величин условного стандартного потенциала, свидетельствующих о комплексообразовании ионов меди в этих электролитах.
2. Теоретическая часть
Методов измерения абсолютных значений электродного потенциала не существует, поэтому принято электродным потенциалом называть ЭДС между данным электродом и электродом сравнения.
За стандартный потенциал в водородной шкале принят потенциал рассматриваемой системы относительно водородного электрода сравнения
в стандартных условиях: концентрация 1 г × моль / л, температура 25° С, давление 1 атм.
Стандартные потенциалы зависят от среды и температуры. В справочной литературе наряду с величинами стандартных потенциалов приводятся значения условных стандартных потенциалов (Е *), связанные со стандартными потенциалами (Е °) и константами нестойкости образующихся в электролите комплексных ионов (К н) выражением
Е *= Е °+ 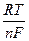 ln К н. (7.1)
ln К н. (7.1)
Зная температурную зависимость Е * для определенного растворителя, легко рассчитать величину равновесного потенциала для любой концентрации ионов Меn+ и температуры по уравнению Нернста:
E=E *+ 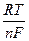 ln C мen+. (7.2)
ln C мen+. (7.2)
Концентрация ионов Me n+ выражается в молях/литр.
Температурную зависимость Е * устанавливают экспериментально по аналогичной зависимости равновесного потенциала при известной концентрации ионов Меn+.
3. Аппаратура и методика эксперимента
Схема экспериментальной установки показана на рис. 7.1.
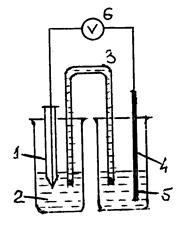
Рис. 7. 1.Схема установки:
1 – хлорсеребряный электрод сравнения; 2 – стакан с насыщенным раствором KCl; 3 – электролитический ключ, заполненный насыщенным раствором KCl; 4 – стакан с исследуемым электролитом; 5 – медный электрод; 6 – цифровой вольтметр
Измерения ЭДС осуществляют относительно хлорсеребряного электрода сравнения высокоомным цифровым вольтметром.
Работа выполняется по вариантам:
1-й вариант. Измерение величин равновесных потенциалов в зависимости от концентрации ионов меди 8, 12, 20 г/л при постоянной концентрации серной кислоты 140 г / л.
2-й вариант. Измерение величин равновесных потенциалов в зависимости от концентрации серной кислоты 80, 140, 200 г/л при постоянной концентрации ионов меди 12 г / л.
3-й вариант. Измерение величин равновесных потенциалов в зависимости от концентрации ионов меди 0,1; 0,2; 0,5 моль/л в отсутствие серной кислоты.
4. Порядок выполнения работы
1. Ознакомиться с методическими указаниями по выполнению работы, ответить на контрольные вопросы.
2. Собрать измерительную схему. Правильность сборки проверяет преподаватель.
3. Включить цифровой вольтметр и измерить величину равновесного (устойчив в пределах ± 0,005 В в течение 5 мин) потенциала меди в исследуемом электролите. После этого заменить электролит и продолжить измерения в этом электролите.
4. После окончания работы электрохимическую ячейку, электролитический ключ, промежуточный стакан и электроды промыть водой и вытереть фильтровальной бумагой.
Хлорсеребряный электрод сравнения опустить в стакан с дистиллированной водой.
5. Обработка результатов измерений
Результаты измерений и расчетные данные заносят в следующую таблицу:
| № | Состав электролита, моль/л | t,°C | Е равн, В | Е `отн.вод,В | Е *,В | К н |
Равновесные потенциалы меди, измеренные относительно хлорсеребряного электрода сравнения (Е), пересчитывают относительно водородного электрода сравнения (Е `), зная температурную зависимость для потенциала хлорсеребряного электрода:
Е = 0,2385 – 0,000649 t. (7.3)
При 20° С Е = 0,2256В, при 25° С – 0,2223В.
Затем по величинам Е ` и уравнению (7.2) рассчитывают значения условного стандартного потенциала меди (Е *). Сравнение его величины со стандартным потенциалом меди
Е 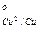 = 0,337 + 0,008 · 10-3(t -25). (7.4)
= 0,337 + 0,008 · 10-3(t -25). (7.4)
При 20° С Е о = 0,33696 В, при 25° С – 0,337 В). Сравнение с величинами
Е * позволяет сделать заключение о комплексообразовании в системе,
по соотношению (7.1) следует оценить величину константы нестойкости.
6. Контрольные вопросы
1.Что такое стандартный, условный стандартный и равновесный потенциалы?
2. Какие электроды применяют в качестве электродов сравнения?
3. Устройство хлорсеребряного электрода сравнения.
4.Влияние комплексообразования на величину условного стандартного потенциала.
5. Взаимосвязь стандартного и условного стандартного потенциалов.
6. Взаимосвязь условного стандартного и равновесного потенциалов.
7. Как экспериментально установить температурную зависимость условного стандартного потенциала?
8. В каких единицах выражается концентрация ионов Меn+?
Работа 7.2. Определение характеристик электролитического получения цинка
1. Цель работы
Работа посвящена экспериментальному определению основных характеристик электролитического получения цинка, а именно определению величин напряжения разложения, обратной ЭДС, рабочего напряжения, выхода по току, удельного расхода электроэнергии, выхода по энергии в исходном и конечном электролитах, применяемых в промышленной практике.
2. Теоретические основы
Процесс электролиза характеризуется величинами напряжения разложения, обратной ЭДС, рабочего напряжения, выхода по току, выхода по энергии, удельного расхода электроэнергии.
Минимальное значение напряжения, которое необходимо приложить к электродам, чтобы начался процесс электролиза с образованием электродных продуктов, называется напряжением разложения (Ен.р).
Методика определения напряжения разложения по кривым i-h и i-U показана на рис. 7.2.
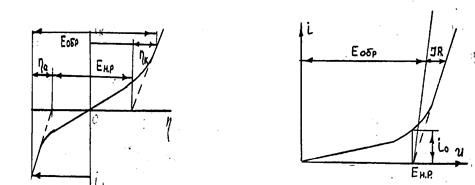
А б
Рис. 7.2. Вид поляризационных кривых в координатах:
i – h (a), I – U (б)
Напряжение разложения может быть также найдено как разность равновесных потенциалов для электродных реакций, реализующихся на аноде и катоде.
Е н.р может быть вычислено и по величинам изменения энергии Гиббса D G р, соответствующей электрохимической реакции
Е н.р = 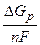 . (7.5)
. (7.5)
Величина обратной ЭДС (Е обр) при определенных i a и i к включает в себя напряжение разложения и величины катодной и анодной поляризации при рассматриваемых плотностях тока (рис. 7.3):
Е обр = Е н.р + h а + h к. (7.6)
С другой стороны величина обратной ЭДС равняется рабочему напряжению на электролизере за вычетом омического падения напряжения в электролите и электродах: IR = IR эл + IR эд.
Е обр = U р – IR. (7.7)
Обратная ЭДС определяется в момент отключения тока электролиза (рис. 7.3).
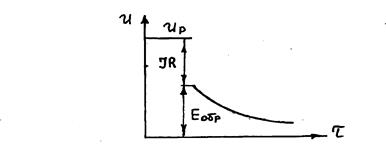
Рис.7.3. Принцип определения обратной ЭДС
Со временем Е обр. уменьшается из-за снижения величин поляризации.
Величина рабочего напряжения, измеряемого на электролизере, равна
U p = Е н.р + h к + h а + IR эл + IR эд + IR пр, (7.8)
где IR пр – падение напряжения в подводящих проводах (ошиновке электролизера).
Важнейшей характеристикой процесса электролиза является величина выхода по току.
Выходом по току h т называется отношение количества вещества, фактически образовавшегося на электроде (m факт), к количеству вещества, которое должно было бы образоваться в соответствии с законом Фарадея (m теор).
Выход по току выражается в долях единицы либо в процентах:
h т= 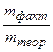 либо
либо 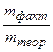 100%. (7.9)
100%. (7.9)
Значение m факт определяется взвешиванием, mтеор рассчитывается по уравнению (7.10).
m теор = q I τ, (7.10)
где q – электрохимический эквивалент цинка 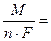
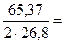 1,22 г / А·ч;
1,22 г / А·ч;
I – сила тока, А;
τ – время электролиза в ч.
Выход по току, как правило, не равен 100%, потому что часть тока расходуется на побочные процессы (i поб).
В частности, на разложение более легко восстановимых веществ расходуется остаточный ток i o (см. рис.7.2). В том случае, если это единственный побочный процесс, выход по току при определенной плотности тока i может быть найден по уравнению
h т = 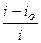 . (7.11)
. (7.11)
Доля тока, расходуемая на побочные реакции, в принципе не одинакова для катодного и анодного процессов, поэтому различают катодный и анодный выходы по току. Необходимо также помнить, что выход по току, строго говоря, не остается постоянным во времени, а изменяется с изменением условий электролиза, поэтому различают выходы по току интегральный (усредненный за все время электролиза) и парциальный (в определенный момент).
Выход по току характеризует эффективность использования по назначению тока электролиза. Для характеристики эффективности использования электроэнергии применяют показатели удельного расхода электроэнергии
(W ф) и выхода по энергии (h э).
Под удельным расходом электроэнергии (W ф) понимают ее количество, затраченное на получение единицы массы продукта электролиза:
W ф= 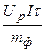 . (7.12)
. (7.12)
Поскольку m ф = m т hт = qIth т, получаем
W ф= 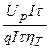 =
= 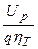 . (7.13)
. (7.13)
Таким образом, величина фактического расхода электроэнергии определяется величинами рабочего напряжения, электрохимического эквивалента и выхода по току.
Выход по энергии (h э) равен отношению минимально возможного удельного расхода электроэнергии на получение данного целевого продукта W т к реальному или фактическому удельному расходу электроэнергии W ф:
h э = 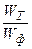 . (7.14)
. (7.14)
По аналогии с уравнением (7.13) для минимально возможного удельного расхода энергии (U p = Е н.р, h т = 1) справедливо уравнение
W = 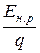 . (7.15)
. (7.15)
Подставив уравнения (7.13) и (7.15) в (7.14), имеем
h э = 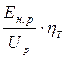 . (7.16)
. (7.16)
Видно, что эффективность использования электроэнергии определяется в равной степени как эффективностью использования тока (h т), так и рациональным использованием рабочего напряжения (Е н.р / U p). Это определяет значимость обоснованной минимизации всех составляющих рабочего напряжения (уравнение (7.8)), исключения, либо сведения к минимуму побочных электрохимических процессов (уравнение (7.11)).
Рассмотренные показатели представляют методологическую основу для исследования и совершенствования реальных электрохимических процессов.
Цинк является электроотрицательным металлом (E oZn2+/Zn = - 0,76 В). Однако вследствие очень низких токов обмена для выделения водорода на цинке
(i o = 1×10-11 А / см2 при i o,Zn = 1×10-5 А / см2) кривые поляризации цинка идут значительно круче, чем водорода. Это дает возможность осаждать цинк из кислых растворов при повышенных i к с приемлемыми выходами по току.
Реакция на катоде (алюминий):
ZnSО4 + 2е = Zn + SO42- (7.17)
На аноде (Pb либо Pb-Ag) имеет место реакция выделения кислорода:
Н2О – 2е = 2Н+ + 1 / 2О2 (7.18)
Суммарная реакция при электролизе
ZnSО4 + Н2О == Zn + 1 / 2О2 + H2SО4 (7.19)
В электролизеры непрерывно поступает нейтральный электролит, содержащий 100–150 г/л Zn2+, а из электролизеров вытекает кислый «отработанный» электролит, содержащий 40-60 г/л Zn2+ и 120-160 г/л H2SО4.
При более низкой концентрации Zn2+ и более высокой концентрации серной кислоты выход по току резко снижается.
На процесс электролиза большое влияние оказывает температура.
Ее повышение снижает быстрее перенапряжение выделения водорода, чем цинка, что отрицательно сказывается на выходе по току. На практике электролиз ведут при температурах не выше 35–40° С (применяют принудительное охлаждение).
Выделяющийся кислород может приводить к аэрозольному распылению электролита (образование «сернокислотного тумана»). Для предотвращения этого явления в электролит вводят пенообразователи («мыльный корень»).
2. Аппаратура и методика эксперимента
Схема установки показана на рис.7.4.
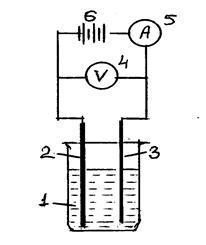
Рис.7.4.Схема установки:
1 – стеклянный стакан с электролитом; 2 – свинцовая пластина, служащая анодом; 3 – стальная либо алюминиевая пластина, служащая катодом; 4 – цифровой вольтметр; 5 – амперметр; 6 – источник постоянного тока
Величина напряжения разложения определяется методом снятия кривой
«ток–напряжение» при последовательном увеличении силы тока на 1 мА. Вид I-V кривых показан на рис. 7.2, б.
Экстраполяция второго прямолинейного участка на ось абсцисс дает искомую величину напряжения разложения.
К этой же величине стремится во времени разность потенциалов электродов после отключения тока электролиза.
Величину обратной ЭДС определяют в момент отключения тока электролиза (первое показание цифрового вольтметра после отключения тока).
Среднее рабочее напряжение при определенной плотности тока определяют по показаниям цифрового вольтметра через каждую минуту электролиза при общей его продолжительности и определенной плотности тока 10 мин.
Массу цинка, выделившуюся при электролизе (m пр), находят по разности масс катода после и до электролиза, определяемых взвешиванием.
Массу цинка, которая должна была выделиться теоретически, рассчитывают по закону Фарадея (уравнение (7.10)).
Выход по току определяют по формуле (7.9). Зная выход по току по уравнениям (7.13) и (7.16), рассчитывают удельный расход электроэнергии и выход по энергии.
Результаты опытов и расчетов заносят в таблицу.
| Плотность тока, А / см2 | 0,02 | 0,04 | 0,06 |
| I,A | |||
| Ен.р., В | |||
| Еобр, В | |||
| Uр.ср, В | |||
| m факт., г | |||
| mтеор, г | |||
| hт, % | |||
| W, кВт · ч / кг | |||
| hэ, % |
По полученным результатам делается вывод об эффективности электролиза и зависимости его показателей от плотности тока, состава электролита.
Работа выполняется по вариантам.
1-й вариант. В качестве электролита используется раствор, содержащий 2 моль / л ZnSO4, 0,1 моль / л H2SO4.
2-й вариант. В качестве электролита используется раствор, содержащий 1,52 моль / л ZnSO4, 1,03 моль / л H2SO4.
Контрольные вопросы
1. Напряжение разложения. Методы его расчета и определения.
2. Обратная ЭДС. Методы ее расчета и определения.
3. Выход по току. Методы его расчета и определения.
4. Составляющие рабочего напряжения.
5. Удельный расход электроэнергии. Методы его расчета.
6. Выход по энергии. Методы его расчета.
7. Электродные процессы при электролитическом получении цинка.
8. Влияние температуры на выход цинка по току.
9. Влияние плотности тока на выход цинка по току.
Работа 7.3. Электрохимическая поляризация
1. Цель работы
Работа посвящена изучению влияния условий электролиза (плотности тока, состава электролита, температуры) на величины электрохимической поляризации, коэффициентов переноса, токов обмена при разряде ионов никеля из различных электролитов, применяемых в промышленной практике.
2. Теоретическая часть
При пропускании постоянного тока через электрохимическую систему происходит изменение скоростей окисления, восстановления, изменяется строение двойного электрического слоя, приводящее к изменению электродного потенциала. Отклонение потенциала под током (Е i)
от равновесного значения (Е р) называется перенапряжением или поляризацией h = Е i – Е р. Различают электрохимическую, концентрационную и фазовую поляризации. При электрохимической поляризации лимитирующей стадией является перенос заряда через плотную часть двойного электрического слоя, т.е. сам акт разряда-ионизации. Теорию электрохимической поляризации разработал академик А.Н. Фрумкин. Для расчета величины электрохимической поляризации при определенной температуре и плотности тока необходимо знать токи обмена (i o) и коэффициента переноса (a).
Ток обмена равен току разряда, току ионизации при равновесном потенциале и характеризует собой интенсивность обмена зарядами между электродом и электролитом при равновесном потенциале.
Коэффициент переноса показывает, какая часть энергии Гиббса переносится на энергию, активную электродной реакции.
В распространенном для гидроэлектрометаллургии случае рабочие плотности тока во много раз превышают токи обмена. При этом величина поляризации связана с катодной плотностью тока уравнением Тафеля
h = а + blgi, (7.20)
где b = – 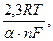
a = – b×lgio,
где n – валентность разряжающихся ионов.
В том случае, если величины i o и a неизвестны, их рассчитывают по экспериментально найденной зависимости поляризации от логарифма плотности тока:
lg i o = – 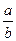 ; a = –
; a = – 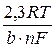 . (7.21)
. (7.21)
Для установления экспериментальной зависимости h от lg i при малых токах обмена применяются методика и аппаратура поляризационных измерений без отключения поляризующего тока.
3. Аппаратура и методика эксперимента
Схема экспериментальной установки показана на рис. 7.5.
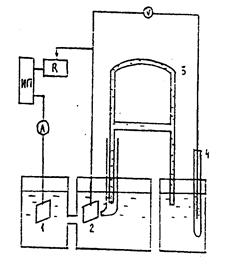
Рис. 7.5. Схема установки:
1– анод; 2 – катод; 3 – электролитический ключ; 4 – электрод сравнения
Электрохимическая ячейка представляет собой Н-образный стеклянный сосуд, в котором катодное и анодное пространства разделены капиллярной перемычкой, заполненной электролитом. Анодом является никелевая пластина, катодом – медный лист, покрытый никелем, с фиксированной (1 см2) рабочей поверхностью, обращенной через капилляр к никелевому аноду. К обратной стороне катода должен быть плотно подведен кончик капилляра Луггина–Гебера, с тем чтобы к минимуму свести искажение результатов за счет омического падения напряжения в электролите. Электролитический ключ, заполненный насыщенным раствором хлористого калия, через капилляр Луггина–Гебера соединяет электрохимическую ячейку со стаканчиком, заполненным таким же раствором, что и электрохимическая ячейка. В стаканчик помещается никелевая пластинка, являющаяся электродом сравнения. Таким образом, измеренная при определенной плотности тока величина ЭДС между поляризуемым никелевым катодом и электродом сравнения является одновременно и величиной катодной поляризации. Измерения ЭДС осуществляют с помощью высокоомного цифрового вольтметра.
Для исследований необходимы:
1. Электрохимическая ячейка.
2. Электролитический ключ.
3. Промежуточный стаканчик.
4. Источник питания стабилизированным током.
5. Капилляр Луггина–Гебера.
6. Цифровой вольтметр.
7. Миллиамперметр со шкалой на 100 мА.
Работа выполняется по вариантам.
Вариант 1. Исследование зависимости поляризации от логарифма плотности тока при комнатной температуре в электролите, содержащем, г / л: (70–75) NiSO4×7H2O; (40–50)Na2SO4×7Н2О; (20–25) H3BO3; (5–7)NaCl; рН 5,6–5,8.
Вариант 2. Исследование зависимости поляризации от логарифма плотности тока при комнатной температуре в электролите, содержащем: 1М NiCl2, 2 % H3BO3.
4. Порядок выполнения работы
1. Ознакомиться с установкой.
2. Заполнить электрохимическую ячейку и стаканчик исследуемым электролитом, закрепить электроды, соединить ячейку и стаканчик электролитическим ключом, заполненным насыщенным раствором хлористого калия.
3. Собрать электрическую схему. Правильность сборки проверяет преподаватель.
4. Измерить равновесный потенциал катода относительно электрода сравнения в отсутствие тока в цепи.
5. Включить ток и установить его, последовательно равным 2, 4, 8, 16, 32, 64 мА и т.д. При каждом значении силы тока электролиз выдерживают 1–2 мин, что необходимо для стабилизации потенциала, после чего его измеряют цифровым вольтамперметром. Опыты повторяют при 40 и 60°С (если это требуется).
6. После окончания работы отключить источник тока, электролит из ячейки и стаканчик сливают в емкость для его хранения. Ячейку, стаканчик промыть водой и вытереть фильтровальной бумагой. Электролитический ключ помещают в стакан с дистиллированной водой.
5. Обработка результатов
Результаты измерений заносят в таблицу.
| Сила тока, А | Плотность тока, А / см2 | ЭДС, В |
По этим данным строят поляризационную кривую в координатах h к = j (lg i к). На графике выявляют область электрохимической кинетики.
Для нее определяют коэффициенты «а » и «b » уравнения Тафеля. По ним
и соотношениям (7.21) рассчитывают коэффициент переноса (a) и плотности тока обмена (i o).
6. Контрольные вопросы
1. Сущность понятия «поляризация электродов».
2. Виды поляризации.
3. Природа электрохимической поляризации.
4. Сущность понятий «ток обмена», «коэффициент переноса».
5. В каких случаях справедливо уравнение Тафеля?
6. Связь коэффициентов «а» и «b» уравнения Тафеля с величинами тока обмена и коэффициента переноса.
Работа 7.4. ЗАКОН ОМА В ИОННЫХ ПРОВОДНИКАХ.
УДЕЛЬНАЯ И ЭКВИВАЛЕНТНАЯ ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ
Цель работы
Работа посвящена изучению приложимости закона Ома к растворам электролитов и зависимости удельной и эквивалентной электропроводностей от концентрации и температуры электролита.
2. Теоретическая часть
Электролиты, подобно другим проводникам, оказывают сопротивление прохождению черезних электрического тока. Это сопротивление можно найти по формуле
R = r 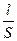 . (7.22)
. (7.22)
Удельное сопротивление r зависит от природы электролита. Если электролитический проводник имеет форму куба, длина ребра которого равна 1 см, то 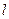 = 1 см, S = 1см2 и R = r. Следовательно, удельное сопротивление есть сопротивление куба, длина ребра которого равна 1 см.
= 1 см, S = 1см2 и R = r. Следовательно, удельное сопротивление есть сопротивление куба, длина ребра которого равна 1 см.
Сопротивление электролитов мало зависит от приложенного извне напряжения. Следовательно, дляних справедлив закон Ома:
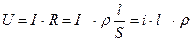 . (7.23)
. (7.23)
Удельная электропроводность 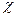 есть величина, обратная удельному сопротивлению проводника. Она измеряется в обратных омах на сантиметр (Ом-1, см-1):
есть величина, обратная удельному сопротивлению проводника. Она измеряется в обратных омах на сантиметр (Ом-1, см-1):
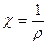 . (7.24)
. (7.24)
Из уравнений (7.22) – (7.24) следует, что
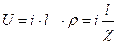 . (7.25)
. (7.25)
Таким образом, падение напряжения в электролите пропорционально плотности тока i, расстоянию между электродами 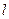 и обратно пропорционально удельной электропроводности
и обратно пропорционально удельной электропроводности 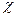 , определяемой природой электролита, концентрацией раствора и температурой. Чаще всего соотношение(7.25) применяют для подсчета падения напряжения в электролите при известной удельной электропроводности и заданной плотности тока. Его можно использовать также для приближенного определения электропроводности, однако это затруднено тем, что в электрохимической цепи имеются границы электрод-электролит, для которых закон Ома неприменим (электродная поляризация); таким образом, R гр = f (i). Пренебречь этой зависимостью можно лишь при очень малых токах.
, определяемой природой электролита, концентрацией раствора и температурой. Чаще всего соотношение(7.25) применяют для подсчета падения напряжения в электролите при известной удельной электропроводности и заданной плотности тока. Его можно использовать также для приближенного определения электропроводности, однако это затруднено тем, что в электрохимической цепи имеются границы электрод-электролит, для которых закон Ома неприменим (электродная поляризация); таким образом, R гр = f (i). Пренебречь этой зависимостью можно лишь при очень малых токах.
Удельная электропроводность 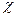 как для сильных, так и для большинства слабых электролитов зависит от концентрации раствора. При этом с возрастанием концентрацииудельная электропроводность достигает максимума, а затем уменьшается.
как для сильных, так и для большинства слабых электролитов зависит от концентрации раствора. При этом с возрастанием концентрацииудельная электропроводность достигает максимума, а затем уменьшается.
Объясняется это следующим образом. При уменьшении концентрации раствора удельная электропроводность должна уменьшаться, так как уменьшается число ионов, переносящих электричество в растворе. Но, с другой стороны, при этом уменьшаются силы взаимодействия между ионами, а это делает их более подвижными, что ведет к возрастанию электропроводности. Последний эффект преобладает в концентрированных растворах. По мере разбавления главную роль начинает играть уменьшение 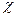 вследствие концентрации.
вследствие концентрации.
Ввиду сложности зависимости 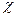 = f(c) e в электрохимии часто пользуются понятием эквивалентной электропроводности.
= f(c) e в электрохимии часто пользуются понятием эквивалентной электропроводности.
Эквивалентная электропроводность (l,Ом-1×см2) есть электропроводность 1 г/экв растворенного электролита, помещенного между электродами, расположенными на расстоянии 1см друг от друга.
Очевидно, что
l 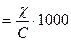 , (7.26)
, (7.26)
где С – концентрация раствора, г×экв / л.
3. Аппаратура и методика эксперимента
Работа выполняется на экспериментальной установке, представленной
на рис. 7.6.
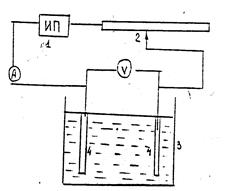
Рис. 7.6. Схема установки:
1– источник тока; 2 – реостат; 3 – ячейка; 4 – электроды
Для исследования необходимы:
1) источник питания на 4 В;
2) термометр;
3) линейка;
4) электролизер – стеклянный сосуд с медными электродами – катодом и анодом (К, А) – в виде пластинок с одинаковой площадью;
5) амперметр со шкалой до 1 А;
6) вольтметр со шкалой до 5 В;
7) реостат.
При выполнении работы важно соблюдать условия:
1) катодная и анодная плотности тока должны быть минимальными, чтобы избежать заметных искажений результатов из-за электродной поляризации;
2) оба электрода должны быть из одного металла (медь); в противном случае возникает обратная ЭДС, обусловленная различной величиною электродных потенциалов. Кроме того, если анод будет изготовлен из инертного металла (латунь),то на нем будет выделяться кислород (большая поляризация).
4. Порядок выполнения работы
1.Ознакомиться с установкой.
2.Собрать электрическую схему. Правильность сборки проверяет преподаватель.
3.В электролизер залить исследуемый раствор сернокислой меди. Электроды закрепляют неподвижно (например, при l =10 см) и измеряют падение напряжения приизменении силы тока от 0,05 до 1,0 А. Каждый раз, увеличивая силу тока на 0,1 А, снимают показания вольтметра. Измерения проводят
7–10 раз. Полученные результаты выражают графически в виде зависимости
U = f (i) при l = const и рассчитывают значение 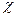 по уравнению(7.25).
по уравнению(7.25).
После этого электроды устанавливают на расстоянии 0,5 см. Затем включают ток 0,2 А и спустя несколько минут записывают показания вольтметра. Далее увеличивают расстояние между электродами последовательно через 1,5 см
до 9–12 см, поддерживая величину тока постоянной и записывая каждый раз показания вольтметра.
Пo опытным данным строят график зависимости U = f (l) при l = const. Тангенс угла наклона вычерченной кривой приближенно равен i / 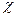 , что при известной плотности тока позволяет определить удельную электропроводность раствора.
, что при известной плотности тока позволяет определить удельную электропроводность раствора.
4. По уравнению (7.26) рассчитать значение эквивалентной электропроводности.
5. Вторая часть работы заключается в установлении зависимостей удельной и эквивалентной электропроводностей от концентрации раствора. Для этого установить постоянное расстояние между электродами и измерение U = f (i) провести при различных концентрациях раствора.
По опытным данным определить зависимости U = f (i), по ним построить графики 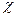 = f (с), l = f (с).
= f (с), l = f (с).
6. Для иллюстрации связи падения напряжения в электролите с удельной электропроводностью исследуют зависимость напряжения от температуры.
С этой целью нагревают электролит до 70° С (в отдельной колбе) и по мере остывания его через каждые 5° С записывают показания вольтметра, поддерживая величину тока и расстояние между электродами постоянными.
5. Обработка результатов опыта
Результатыизмерения и расчетные данные заносят в таблицы. Расчеты величины удельной электропроводности выполняют по уравнению (7.25).
В заключение делают выводы о зависимости удельной и эквивалентной электропроводностей от концентрации сернокислой меди и температуры электролита.
6. Контрольные вопросы
1. Определение удельной и эквивалентной электропроводности.
2. Как и почему изменяется с концентрацией удельная электропроводность?
3. Почему измерение сопротивления желательно производить на переменном токе?
4. Почему электропроводность растворов электролитовзависит от природы электролита и растворителя?