Введение.
Эфирамиды алкандиовых кислот – довольно редкие соединения. Их синтез представляет собой сложную задачу, поскольку получить их напрямую из щавелевой, малоновой или других кислот трудно. По большей части упомянутые эфирамиды используются как полупродукты в синтезе различных биологически активных соединений. Таким образом, вопрос синтеза эфирамидов алкандиовых кислот имеет высокую актуальность. Также, эфирамиды – это полузащищенные диовые кислоты.
С точки зрения ретросинтетического подхода может быть несколько способов синтезировать данные соединения:
· Синтез с использованием реакции Гриньяра

· Синтез с использованием галогензамещённых карбоновых кислот

Поскольку обзоров на тему синтеза амидоэфиров алкандиовых кислот довольно мало, этот реферат должен занять эту нишу.
Синтез эфирамидов алкандиовых кислот.
2.1. Синтез эфирамидов щавелевой кислоты.
В работе [1] показан метод синтеза 1,3-диазолов через стадию получения эфирамида щавелевой кислоты. Было установлено, что диалкилоксалаты вступают в реакцию с различно замещёнными мочевинами с получением упомянутых продуктов. В общем виде синтез проходит следующим путём: диэфир щавелевой кислоты вступает в реакцию с замещённой мочевиной в присутствии оксида дибутилолова (DBTO). В результате получаются упомянутые эфирамиды и карбаматы, которые вступают в конденсацию с получением имидазол-2,4,5-триона (рисунок 1).

Рисунок 1
Ниже приведена таблица с наибольшими выходами, в зависимости от заместителей.
| Исходная мочевина | Конверсия, % | Выход эфирамида, % | Выход имидазола, % |

| |||

| 2,5 | ||

|
Стоит отметить, что выходы падают пропорционально росту акцепторности заместителей при азотах мочевины. В частности, если R1 = 4-O2N-C6H4, ни одна реакция не идёт.
В данной работе интерес представляет также и выбор катализатора (рисунок 2).

Рисунок 2
Олово часто применяется в органическом синтезе часто используется, как кислотный катализатов в реакция этерефикации и переэтерификации. Однако, для данной реакции его кислотность мала. Акцепторные же группы (кислород) увеличивают его кислотность. Данный катализатор по своей природе амфотерен, интересен способ активации оксалатов (рисунок 3).
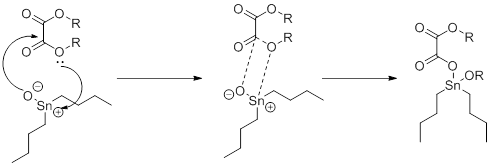
Рисунок 3
В публикации [2] также представлен метод синтеза эфирамида щавелевой кислоты, правда, совсем иным методом и для иных целей (рис. 4).

Рисунок 4
Реакция проходит на ледяной бане в течение сорока минут в инертной атмосфере. Несмотря на то, что сам синтез препаративно значительно проще, проблема, обозначенная во вступлении к реферату отнюдь не решена, поскольку синтез этилоксалилхлорида по сложности практически аналогичен. Тем не менее, в некотором роде, поставленную задачу данная публикация решает. Интересно также и то, для каких целей был получен данный полупродукт. Было показано, что данное соединение в присутствии солей низковалентного титана и цинка циклизуется с получением индолов (рис. 5).

Рисунок 5
Вторая часть синтеза известна как реакция МакМурри. Эта реакция широко используется для синтеза олефинов. Тем не менее, она имеет ряд недостатков. Например, она низкоселективна, хотя, в данном случае, это неважно. Условия реакции жёсткие, но функциональные группы, имеющиеся в исходной молекуле довольно устойчивы к восстановлению. Реакция применима для получения стерически затруднённых алкенов, особенно для внутримолекулярной циклизации.
В работе сотрудников Университета Кембриджа [3] использован, как будет показано ниже, самый популярный метод получения эфирамидов – гидролиз эфирнитрилов. Было показано, что ароматические, гетероциклические и алифатические нитрилы в смеси с водой при продувании через диоксид марганца превращаются в амиды. Интересно, что данный метод применим для промышленной реализации, поскольку он даёт высокие выходы, а также катализатор, который в нём используется, довольно дешёвый. Общий ход реакции можно изобразить следующим образом (рис. 6):

Рисунок 6
Интересно, что амидная группа в условиях реакции (30-110⁰С) не подвергается гидролизу. Выходы почти всех проведённых синтезов превышали 90%. Были осуществлены попытки провести реакцию в присутствии других металлических катализаторов, но, несмотря на их эффективность, они гораздо дороже сами по себе, а также требуют инертную атмосферу. Схема интересующей нас реакции выглядит следующим образом (рисунок 7):

Рисунок 7
В отличие от работ, представленных выше, этот метод применим только для синтеза незамещённых оксаматов, что несколько сужает круг его возможностей.
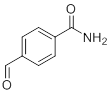
Как видно из данных, приведенных в последующей таблице, метод достаточно селективный, никакие группы, кроме нитрильной в ходу реакции не окисляются. Он показал высокие выходы на гетероциклических, ароматических и алифатических амидов.
| Нитрил | Амид | Выход, % |
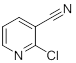
| 
| |

| 
| |

| 
| |

| 
|
Чаще всего на практике интересующие нас соединения получают ионными реакциями. Тем интереснее становится работа [4], потому как там оксаматы получают реакцией α-ацетиламидов с церийаммонийнитратом, то есть, проводя реакцию одноэлектронного переноса. Это даёт синтезу очень многое. Реакции проходят быстро (как правило, менее часа), в мягких условиях и дают высокие выходы. Привычно думать, что радикальные реакции низкоселективны или неселективны вовсе. Данная реакция напротив показывает высокую селективность, за редким исключением.
Интересно отметить, что изначально работа была посвящена синтезу совсем иных соединений. Была осуществлена попытка синтеза дигидроиндолов слледующим путём (рис. 8):

Рисунок 8
Однако, реакция пошла совсем по иному пути, по-видимому из-за присутствия кислорода воздуха (это следует из приведённого в публикации предполагаемого механизма) (рис. 9).

Рисунок 9
Хотя оксамат получился с умеренным выходом (51%), авторами было принято решение изучить реакцию образования оксаматов из N -арил-2-ацетилацетамидов. В общем виде проведённые синтезы можно изобразить следующим образом (рис. 10):
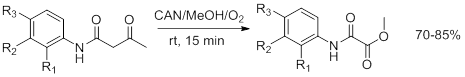
Рисунок 10
Самый низкий выход дал амид с незамещённым фенилом при атоме азота. Это отчасти объясняет сравнительно низкий выход в первой реакции. Зависимость выхода от заместителей представлена в таблице ниже:
| R1 | R2 | R3 | Выход, % |
| Н | Н | Н | |
| Н | Н | Me | |
| Н | Н | OMe | |
| Н | Н | Cl | |
| Me | H | H | |
| OMe | H | H | |
| COOMe | H | H | |
| H | Br | H |
Стоит отметить, что были проведены синтезы и с алифатическими заместителями при атоме азота. В тех же условиях были показаны даже более высокие выходы (рис. 11).
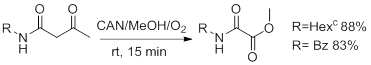
Рисунок 11
По-видимому дигидроиндолы не получились из-за присутсвия кислорода воздуха. В процессе образуется диацильный радикал, который может вступить в циклизацию с бензольным кольцом, но бирадикальная молекула кислорода занимает это место раньше (рис. 12).
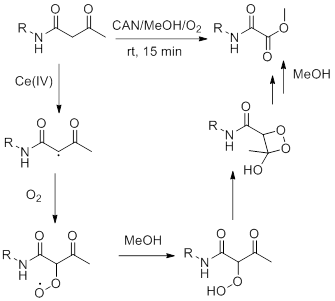
Рисунок 12
2.2. Синтез эфирамидов малоновой кислоты.
В работе [5] представлен метод синтеза эфирамидов малоновой кислоты из её полуэфиров. Полученные продукты обладают интересными свойствами. Показанный ниже синтез был проведён с высоким выходом (89%) (рис. 13).

Рисунок 13
Благодаря тому, что полученное соединение всё ещё обладает С-Н кислотностью, его можно проалкилировать (что и было сделано), с последующей циклизакией с получением дигидроиндолов по следующей схене (рис. 14).
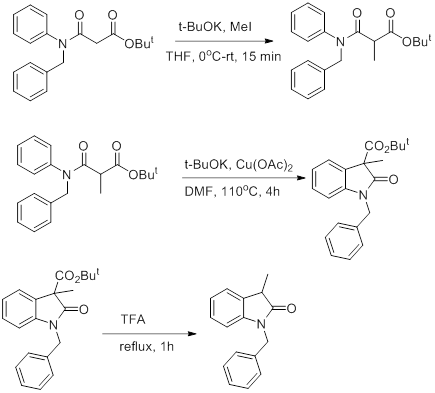
Рисунок 14
Также интересная работа была проведена сотрудниками Технологического университета в Будапеште [6]. Была исследована реакция окисления нитрилов до амидов. В присутствии платинового или медного катализатора и оксима ацетальдегида в различных растворителях были получены различные амиды с высокими выходами. Общая схема реакции изображен на рис. 15.

Рисунок 15
В качестве растворителя были применены: диэтиловый эфир, метанол, этилацетат, этанол и толуол. В каждом из них, при разных температурах были получены высокие значения конверсии исходного нитрила. Данные по подбору соотношения «растворитель-температура» приведены в нижеследующей таблице.
| Растворитель | Температура, ⁰С | Конверсия, % |
| Диэтиловый эфир | ||
| Метанол | ||
| Этилацетат | ||
| Этанол | ||
| Толуол |
При такой высокой конверсии наблюдались почти количественные выходы – до 97%. Есть некоторая зависимость между структурой сходного нитрила и выходом, каковая будет представлена ниже. Интересующее нас соединение было получено аналогичным методом по следующей реакции (рис. 16):
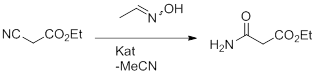
Рисунок 16
Интересно, что по большей части, самые высокие выходы давали реакции окисления нитрилов непредельных кислот, однако, эта закономерность не носит общий характер.
| Исходный нитрил | Полученный амид | Выход, % |

| 
| |

| 
| |

| 
| |

| 
|
2.3. Синтез эфирамидов янтарной кислоты.
Сразу две работы [7] и [8] посвящены, в числе прочего, синтезу эфирамидов янтарной кислоты из её нитрила. По сути, они отражают одну и ту же работу, посвящённую исследованию гидрирования нитрилов на рутениевом катализаторе. Было показано, что нитрилы гидрируются до амидов в присутствии тетракис-(трифенинфосфин)рутения. В частности, этилсукцинонитрил в данных устловиях превращается в этилсукцинамид с выходом 93% (рис. 17).

Рисунок 17
Вообще, работа посвящена синтезу пумилиотоксина, а также изучению внутримолекулярной циклизации δ-оксоамидов с получением ен-лактамов. Ясно, что с помощью такого метода можно получить различные гетероциклы, в том числе и конденсированнные.
Использование данного катализатора позволяет гарантировать высокие выходы (до 97%) и селективность, поскольку другие функциональные группы воздействию не подвергаются. Например, ацето- и бензамид получились с выходом 92%. Ниже представлены две реакции с образованием двух конденсированных гетероциклов в тех же условиях (рис. 18).
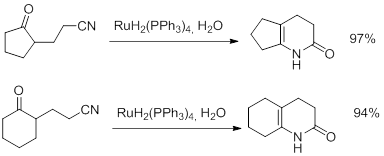
Рисунок 18
Стоит, однако, отметить, что во второй реакции могут образовываться два изомерных продукта (рис. 19).
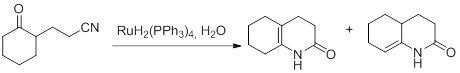
Рисунок 19
Суть синтеза, проведённого в работе [9] совсем иная. Там используется не полунитрил янтарной кислоты, а диметилсукцинат. Как же тогда удалось обеспечить селективность? Дело в том, что в качестве катализатора был применен фермент Candida Antarctica lipase (CAL). Это позволило не только получить эфирамиды, но и синтезировать оптически активные сукцинимиды, причём стереоселективно.
Условия, в которых проводился синтез довольно мягкие: 30⁰С, диоксан или гексан. Интересно, что здесь от растворителя зависела структура продукта (рис. 20).
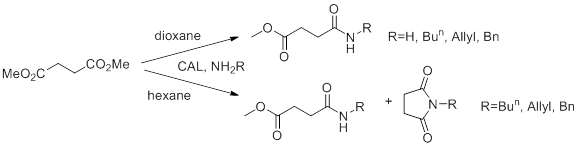
Рисунок 20
Недостатком метода является, пожалуй, продолжительность реацкии – 31 час. Если же в альа-положении к карбоксильной группе будет некий заместитель, создающий хиральный центр, то в результате синтеза, проведённого в гексане, будет получаться, наряду с различными эфирамидами, только один стереоизомер циклического сукцинимида (рис. 21).

Рисунок 21
2.4. Синтез эфирамидов глутаровой кислоты.
В работе [10] эфирамиды глутаровой кислоты получали по механизму радикального присоединения. Было установлено, что метилакрилат реагирует с метилбромацетатом в брисутствии источника радикалов за 15 часов по следующей схеме (рис. 22):

Рисунок 22
Было показано, что при реакции с иодацетамидом могут образовываться эфирамиды глутаровой кислоты, которые при последующем нагревании до 120⁰С дают в качестве продуктов глутаримиды (рис. 23). Стоит отметить, что если в качестве исходного вещества взять, например коричную кислоту, то в конце будет получен замещённый в четвёртом положении глутаримид.

Рисунок 23
Заключение.
Как было показано в реферате, несмотря на небольшое количество статей, посвящённых именно синтезу эфирамидов диовых кислот, эта область органического синтеза имеет колоссальное значение, так как данные соединения являются веществами-предшественниками огромного количества биологически-активных соединений. Не все из предложенных синтезов пригодны для промышленного использования, но это, как известно дело поправимое.
Стоит отметить, что в синтезе данных веществ особое положение занимают радикальные синтезы, дающие наибольшие выходы, при наименьших затратах. Не стоит, однако, недооценивать и ионные реакции, которые, как показал этот обзор также зачастую показывают прекрасные результаты.
Эфирамиды алкандиовых кислот – синтетические предшественники различных гетероциклов, веществ безгранично важных и перспективных. Вопрос их синтеза не перестаёт быть актуальным, это видно хотя бы по датам публикаций большинства статей, перечисленных ниже.
Список литературы
1. Kunde, L. B., Kalyani, V. S. & Gupte, S. P. Dibutyltin oxide catalyzed aminolysis of oxalate to carbamate, oxamate and derivatives of imidazolidine trione. 402–407 (2010).
2. Alois Fürstner, Achim Hupperts, and G. S. ETHYL 5-CHLORO-3-PHENYLINDOLE-2-CARBOXYLATE. Org. Synth. 10, 382 (2014).
3. Battilocchio, C., Hawkins, J. M. & Ley, S. V. Mild and Selective Heterogeneous Catalytic Hydration of Nitriles to Amides by Flowing through Manganese Dioxide. Org. Lett. 1–4 (2013).
4. Nair, V. & Sheeba, V. A Facile CAN-Mediated Transformation of Acetoacetamides to Oxamates †. J. Org. Chem. 64, 6898–6900 (1999).
5. Taylor, D. S. P. and R. J. K. Preparation of 3-Alkylated Oxindoles from N-Benzyl Aniline via a Cu(II)-Mediated Anilide Cyclization Process. Org. Synth. 89, 438–449 (2012).
6. Kiss, Á. & Hell, Z. A heterogeneous catalytic method for the conversion of nitriles into amides using molecular sieves modified with copper (II). Tetrahedron Lett. 52, 6021–6023 (2011).
7. Shun-Ichi Murahashi,* Shigehiro Sasao, Eiichiro Saito, and T. N. Ruthenium-Catalyzed Hydration of Nitriles and Transformation of &Keto Nitriles to Ene-Lactams. J. Org. Chem. 57, 2521–2523 (1992).
8. Shun-Ichi Murahashi,* Shigehiro Sasao, Eiichiro Saito, and T. N. Ruthenium-Catalyzed Hydration of Nitriles and Transformation of GKetonitriles to Ene-lactams: Total Synthesis of (-) -Pumiliotoxin C. Tetrahedron 49, 8805–8826 (1993).
9. Puertas, S., Rebolledo, F. & Gotor, V. Selective Ammonolysis and Aminolysis of Dimethyl Succinate. Synthesis of Optically Active N-Alkylsuccinimides. Tetrahedron 51, 1495–1502 (1995).
10. Sacripante, G., Tan, C. & Just, G. SYNTHESIS OF 4-SUBSTITUTED GLUTARIMIDES BY FREE RADICAL ADDITION OF IODOACETAMIDE TO a,8-UNSATURATED ESTERS. Tetrahedron Lett. 26, 5643–5646 (1985).