Несколько брадизоитных связанные гены, наиболее тесно связанные с антигенами, идентифицированных с помощью моноклональных антител, которые были клонированы и охарактеризованы, в том числе BAG1, MAG1, BSR4 (P36), LDH2 и SAG4A (p18) (Parmley и соавт, 1994, 1995;. Bohne и др аль., 1995; Янг и Parmley, 1995, 1997;. Odberg-Ferragut и др, 1996; Knoll и Boothroyd, 1998a, 1998b). Случайные последовательности кДНКа библиотек (проекты EST) из bradyzoites и тахизоитов привели к идентификации многочисленных генов стадии конкретной. Списки брадизоитного конкретных ЭЕТ доступны в https://www.cbil.upenn.edu/apidots/ и HTTP: // cmgm.stanford.edu/micro/boothroyd/toxo1.html. Гены, индуцируемые на брадизоитном отличительном Тион или уникальном для библиотек брадизоитных также были идентифицированы, но большинство из них кодируют белков неизвестной функции (Ajioka, 1998;. Ajioka и др, 1998; Manger и др., 1998а). Дополнительные усилия с спорозоитами, а также другими тахизоят и брадизоитные библиотеками идут, и accessi-BLE в https://toxodb.org (Li и др., 2003), а также 12X охват Gondii генома T..
Брадизоитные специфические гены также были идентифицированы-Fied с использованием библиотекой кДНКа подхода субтрактивного

352 РАЗВИТИЕ брадизоитного
(Yahiaoui и др., 1999). Шестьдесят пять кДНКа-клоны были проанализированы с брадизоитной вычитательном библиотекой кДНКа; из них, многие из них были идентифицированы, которые были исключительно или преимущественно транскрибируется в Брейди zoites. Это включало гомологи шаперонов (митохондрии белка теплового шока 60 и Т комплекс белка 1), азот фиксации белка, ДНК ремонта повреждений белок, белковые КЕ2, phophatidyli-nosoitol синтазы, глюкозо-6-фосфат-изомеразы, и енолазы. Дифференциальный дисплей также подтверждает различия в экспрессии генов между Brady-zoites и тахизоитами (Roos неопубликованным; Knoll и Бутройд, 1998a).
Последовательный анализ экспрессии генов (SAGE) был использован, чтобы понять прогрессирование экспрессии генов в процессе формирования брадизоитного (Radke и др., 2005). Время конечно 15-дня генов, индуцируемых в течение запрограммированного развития брадизоитного из СПОРО-инфицированных культур zoite, а также генов, индуцированных стрессом рНа, доступно из анализа тега SAGE (https://vmbmod10.msu.montana.edu/ VMB / белая-лаборатория / newsage1.htm). В целом, данные SAGE наводят, что Т. гондий проходит запрограммированную реакцию, подобную дифференциацию малярийного плазмодия, с регулированием координат «точно в срок» групп генов в ходе этого развития, умственная программы (Радке и др. 2005). Уникальный мРНК стадиеспецифический отмечают фенотипические переходы видны в развитии паразита. Кроме того, тип II, и
III штаммы, которые более способны к дифференциации брадизоитной, содержат брадизоитные метки SAGE, предполагая, что там грунтование развития генной экспрессии.
Микромножества обогащенных брадизоитного специфического кДНКа, полученный из секвенирования брадизоитных библиотек были использованы для идентификации группы генов, которые также скоординированно регулируется во время дифференцировки брадизоитной (Manger и др, 1998о;. Клири и др., 2002). Эти анализы подтвердили индукцию ранее описанных генов брадизоитных, т.е. BAG1, LDH2 и SAG4A, и идентифицированы другие потенциальные гены брадизоитных специфичным. В Адди-ции, были показаны гены, как известно, не регулируется во время дифференцировки, чтобы иметь измененную экспрессию мРНК (Клири и др., 2002). Данные этих исследований и генетических исследований свидетельствуют о том, что брадизоитный дифференциация представляет собой сложный путь.
Несмотря на идентификацию многих брадизоитных специфических генов, а также Т. гондий мутантов, которые не способны дифференцировать, единая модель для дифференциации брадизоитной до сих пор не разработана. Некоторые темы, однако, возникли из имеющихся данных:
1. Тахизоиты и bradyzoites выразить родственные гены, кодирующие структурные гомологи взаимоисключающим образом.
2. Метаболические гены, которые существуют стадия конкретной, предполагая, эти этапы метаболический различны.
3. Связанные со стрессом пути дифференцировки и стрессовые белки связаны с этими переходами стадии.
4. Вполне вероятно, что координировать регулирование разви-opmental программы существует, и некоторые из элементов управления этой программы включают хроматин.
Киста СТЕНЫИ MATRIX
АНТИГЕНЫ

Развитие ткани стенки кисты и матриц являются ранними событиями в процессе брадизоитного отличаются-entiation. Цист-стенные белки обнаруживаются в то же время, как другие брадизоитный специфичные антигены, такие как BAG1 (Гросс и др, 1996; Zhang. И др., 2001). Важная функция кистозной стенки и матриц для защиты bradyzoites от тяжелых условий окружающей среды, таких как обезвоживание. Кроме того, эти структуры обеспечивают физический барьер для размещения иммунной защиты. Многое из этого может быть связано с углеводами, присутствующими в стенке кисты. Киста стенка является модификацией брадизоитного пара-sitophorous мембраны вакуоли, образованной паразитом, который заключен в хосте-клеточной мембране - т.е. кисты ткани являются внутриклеточными (Scholytyseck и соавт, 1974; Фергюсон и Hutchison, 1987b.). На электронной микроскопии,
Киста стенка является периодической кислотно-Шифф (ССА) положительной, пятно с некоторыми серебряными пятнами, и связывает лектин

| Киста СТЕНЫИ МАТРИЦА АНТИГЕНЫ |

A
В
С
Рисунок 13.3 Электронная микроскопия кистозной стенки Т. гондий изолирована от мышиного мозга.
(A) Просвечивающая электронная микроскопия стенки кисты.
(B) Иммуноэлектронная микроскопия кисты окрашивала мАтом 73.18, показывающей маркировку матрицы кисты стенки (20 нм золота). Bar = 1 мкм.
(C) Иммуноэлектронная микроскопия цист, окрашенной Dolichos biflorus лектин демонстрируя маркировки матрицы кисты стенки (10 нм золото). Bar = 1 мкм.
Рисунок воспроизведен с разрешения Zhang и др., 2001.
из Dolichos biflorus (DBA) и лектин succiny-веден-зародышей пшеницы агглютинина (S-WGA), предполагая, что полисахариды присутствуют в этой структуре (Симс с сотр 1988;. Boothroyd и др, 1997;.. Дубей и др 1998;. Гимарайнш и др, 2003). Связывание этих лектинов к кист ткани может быть подавлена конкуренцией своими специфическими сахарных гаптенов - N-ацетилгалактозамин (GalNAc) для администраторов баз данных и N-ацетилглюкозамина (GlcNAc) для S-WGA (Boothroyd и др., 1997). Лечение с хитиназой разрушает стенки кисты и устраняет связывание S-WGA, предложить-кий, что хитин или аналогичный полисахарид может присутствовать в этой структуре (Boothroyd и др., 1997).
Связывание лектин DBA является маркером формирования кисты стенки в пробирке. CST1 является 116-кДа гликопротеин признан DBA, а также
моноклональное антитело 73.18 (Вайс и др, 1992;.. Zhang и др, 2001) (рис 13.4). По-видимому, идентично с антигеном, узнаваемым сывороткой животных с хронической инфекцией (Smith, 1993; Zhang и Smith, 1995;. Smith и соавт, 1996), а также с помощью СС2 крысиных моноклональных антител (. Гросс и др, 1995), Лектин наложение эксперименты двумерный гелей позволяют предположить, что лектин АБД и S-WGA распознавать различные антигены, с S-WGA Recog-антигеном вая 48-кДа (Zhang и др., 2001). CST1 локализуется гранулированным материал в стенке кисты под ограничивающей мембраной брадизоитной паразитофорной вакуоли (Zhang и др., 2001; Фергюсон, 2004). Протоколы для очистки стенки кисты в настоящее время разработаны, и должны облегчить идентификацию компонентов белков
A
С
РАЗВИТИЕ брадизоитного

В
<CST1
| R5 2D гель | моноклональное антитело 73,18 |
D
| Dolichos biflorus лектин | S-WGA |
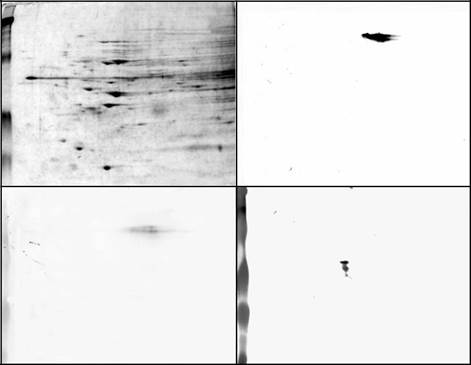
РИСУНОК 13.4 Двумерный электрофорез токсоплазма (R 5) штамм выращивают в человеческих фиброзно-бластов рН 8,1.
(A) Серебро окрашенной 2D геля. Группа обозначается «<» в PI 5.7 и 116 кДом соответствует CST1, как это определена реакционной способности к мАту 73.18.
(B) Иммуноблото из 2D-геля с мАтом 73.18, демонстрирующим, что это антитело реагирует с группой 116-кДа в PI 5.7.
(C) Лектин наложение 2D-геля с использованием Dolichos biflorus лектин. Определены полоса в PI 5.7 и 116 кДа. Эта полоса может быть наложена на иммуноокрашиванию группы, идентифицированной мАтом 73.18.
(D) Лектин наложения с помощью S-WGA. Это свидетельствует о том, что S-WGA локализуется с белком, отличным от идентифицирован DBA и мАтом 73.18.
Рисунок воспроизведен с разрешения Zhang и др. (2001).
| используя Протеомический подход (Zhang и Вайс, | вакуоли Т. гондий (Фергюсон, 2004) (рис 13.5). | ||
| неопубликованной; Чжан и др., 2001). Несколько гликозильная | GRA5 (Lecordier и др., 1993) найден в обоих | ||
| гены трансферазы | в том числе | полипептид | тахизоиты и bradyzoites. По immunohisto- |
| N-acetylgalactosaminyltransferase, которые могут быть | химии, GRA5 локализован в первую очередь к cyst- | ||
| участвует в формировании кисты стены были иден- | стенки мембраны и не гранулированный материал | ||
| Fied, выраженный, и отличающийся тем, Т. гондий | в рамках этой мембраны (Lane и др, 1996;. Фергюсон, | ||
| (Wojczyk и др, 2003;.. Stwora-Wojczyk и др, 2004а, | 2004). Менее интенсивное окрашивание кисты стенки | ||
| 2004b, 2004c). | мембрана демонстрирует антитела к | ||
| Несколько плотных гранул белки (GRA1-8) являются | GRA1, GRA3 и GRA6 (Torpier и др., 1993; | ||
| Известно, локализуются в паразитофорной вакуолярную | Фергюсон, 2004). В настоящее время нет других белков, | ||
| Мембрана, матрица вакуоли, и | присутствуют в стенке кисты были идентифицированы, | ||
| трубчатые конструкции | в пределах | паразитофорной | но, учитывая документированную локализацию |

| Киста СТЕНЫИ МАТРИЦА АНТИГЕНЫ | |||
| A | В | С | |
| GRA8 | GRA1 | GRA2 | |||
| D | Е | F |
| GRA3 | GRA4 | GRA5 | |||
| г | ЧАС | я |
GRA6 GRA7 GRA8

J
NTPase
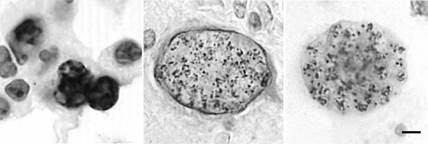
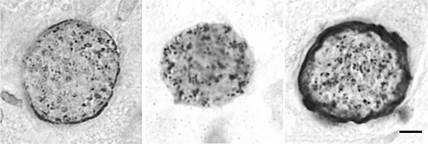
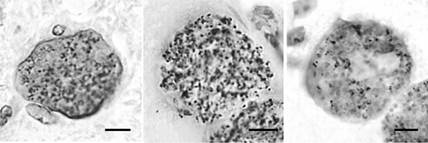
РИСУНОК 13.5 Распределение плотных гранул-белки (СОР) в брадизоитной паразитофорной вакуоле. Представительные секции из легкого остро инфицированных мышей, содержащих тахизоитов (рис 13.5A) и мозг хронически инфицированной мыши, содержащей цисты ткани (Фигуры 13.5B-J). Все секции окрашивали для плотных гранул-белков с помощью техники пероксидазы и соответствующих антисывороток, специфичных для каждого белка GRA. Бары = 5 мкм.
(А) Раздел окрашивали анти-GRA8 показывая сильную маркировку на паразитофорной вакуоли, содержащей тахизоиты.
(В) - (J) Тканевые цисты демонстрируют относительно равномерного окрашивания плотных гранул в пределах bradyzoites (B-I). Было переменное окрашивание стенки кисты с положительным окрашиванием для GRA1 (B), GRA3 (D), GRA5 (F), GRA6 (G), и GRA7 (H), но мало окрашивания GRA2 (C), GRA4 (Е), GRA8 (I), или NTPase (J).
Предоставлено DJP Фергюсон, перепечатано с разрешения Фергюсон (2004).
Эта цифра воспроизводится в цвете в разделе Цвет пластины.

356 РАЗВИТИЕ брадизоитного
количество плотных белков гранул в паре-sitophorous вакуоли, представляется возможным, что многие из белковых компонентов стенки кисты будет известны плотными гранулами белков с новыми модификациями carbohy-drate или брадизоитными специфической глико-белками, секретируемыми из плотных гранул, В поддержку этой идеи в том, что моноклональное антитело крысы СС2 реагирует с антигеном 115-кДа аналогичного (если не иден-Tical) до CST1 в bradyzoites, но распознает белок 40-кДа в тахизоитов (Гросс и др., 1995).
MAG1 первоначально была идентифицирована как белок 65 кДа, выраженный в матрице кисты, которая не была выражена в тахизоите (Parmley и др., 1994). Данные ОТ-ПЦР показывают, что мРНК MAG1 присутствует в обоих тахизоитов и bradyzoites (Parmley и др., 1994). Было показано, что MAG1 также экспрессируется в тахизоитах и секретируется в паразитофорную вакуоль, хотя и менее обильно, чем в bradyzoites (Фергюсон и Parmley, 2002). Антитела к рекомбинантному MAG1 вступает в реакцию с внеклеточным материалом в матрице кисты, и в меньшей степени с кист стеной, но не с поверхностью или цитоплазмой bradyzoites. Плотные-гранул белки GRA1, GRA2, GRA3, GRA5, GRA6 и GRA7 присутствуют в матрице обоих тахизоитов и bradyzoites, но GRA4 и GRA8 оказываются более специфическими для тахизоитов.
В последнее время брадизоитных специфических rhoptry белки, BRP1, были описаны, который секретируется в паразитофорную вакуоль о вторжении (Шварц и др., 2005). Нокаут гена BRP1 не влияет на способность паразита вторжения или образовывать цисты или bradyzoites (Шварц и др., 2005). Моноклональные антитела E7B2 (Lane и др., 1996), 93.2 (Weiss, неопубликованный) и 1.23.29 (Weiss, неопубликованный) также признают матричные антигены, но соответствующие гены не были идентифицированы (табл 13.1).
Поверхностные антигены

Большинство Т. гондий поверхностных антигенов являются членами семейства генов с аналогичной структурой в SAG1 (Boothroyd и др., 1998;. Manger и др, 1998b;. Lekutis и др, 2001). Не ясно, почему так много
существуют члены семьи (по крайней мере 150 генов, хотя некоторые из них псевдогенами), так как антигенной вариации, как описано для трипаносом или малярии не была описана. Все этот НКГ по всей видимости, прикрепляются к мембране с помощью аналогичного гликолипидов якоря. В то время как SAG3 и другие антигены находятся на всех этапах жизни, некоторые из этих поверхностных антигенов, как представляется, стадиеспецифический. SAG1 SRS1-SRS3, SAG2A и SAG2B выражены в тахи- zoites и SAG2C, SAG2D, SAG4A, SAG5A (НКГ 5.1), и SRS9 в bradyzoites (Юнг и др., 2004; Ким и Boothroyd, 2005). Эти антигены могут быть вовлечены в сохранение тканевых кист в их хозяев и относительное отсутствие иммунного ответа на кист ткани (Kim и Бутройда, 2005). Оба SAG3 (p43) и SAG1 (p30) были причастны к адгезии к клеткам-хозяевам. Разрушение SAG3 приводит к двукратный снижению адгезии паразитов (Dzierszinski и др., 2000), но разрушение SAG1 в штамме RH, но не в PLK, приводит к паразитам, которые являются более инвазивными (Минео и др., 1993). Либо SAG1 или SAG3 нарушения в результатах деформации RH приводит к снижению вирулентности (Dzierszinski и др., 2000).
Поверхностные антигены, сходные с SAG1 с законсервированным размещением 12 цистеинов включают SAG1, SAG3 (P43), BSR4 (p36) и SRS 1-4 (НКГ-связанные последовательности), SAG5, SAG5.1 и SAG5.2. Второе семейство поверхностных антигенов, связанных с SAG1 образует группу с менее последовательным сохранением расстояния между цистеином. Эта группа включает SAG2A (SAG2 или P22), SAG2B, SAG2C и SAG2D. SAG2C и SAG2D только обнаружены в естественных условиях bradyzoites не в пробирке bradyzoites, предполагая, что они могут быть выражены позднее в брадизоитном дифференциальном-ции и могут быть маркерами кист созревания (Lekutis и др., 2001).
SAG4 (p18, теперь SAG4A) представляет собой поверхностный белок 18-кДа bradyzoites (Odberg-Ferragut и др., 1996). SAG4 гомолог SAG4.2 (AF015715; SAG4B) также были идентифицированы, и эти гены отличаются от генов SAG1 связанных. SAG4A, подобно BAG1, по-видимому, транскрипционно регулируется во время брадизоитного развития.
BSR4 / p36, или перекрестно реагирующие антигены, представляет собой поверхностный белок на bradyzoites, который реагирует с мАт

| МЕТАБОЛИЧЕСКИЕ РАЗЛИЧИЯ BRADYZOITES И тахизоиты |
T84A12 (Knoll и Boothroyd, 1998b). Первоначально считалось, что брадизоитный конкретным, но также сообщалось в мерозоитами (Ferguson, 2004). BSR4 был изолирован от рН 8,0, обработанных Т. гондий культур в человеческих фибробластов с использованием стратегии промотора ловушки. Этот ген демонстрирует рестрикционную фраг-мента длины полиморфизма между ME49 (PLK; тип II) и CEP (тип III) штаммов, которая коррелирует с отсутствием монАТ T84A12 связывания штамма СЕР. уровни РНК BSR4 подобны в тахизоитами и bradyzoites, предполагая, что после transcrip-онные регулирование BSR4 / P36 происходит через какой-то неизвестный механизм. Срыв BSR4 не приводит к какому-либо фенотипу - то есть не было никакого эффекта на bradyzoites или цист (Knoll и Boothroyd, 1998b).