c(H3O+) = c(HB).
В растворах слабых кислот концентрация ионов гидроксония значительно ниже концентрации кислоты. Она рассчитывается на основании

обеих частей этого уравнения дает формулу для расчета pH растворов слабых кислот: pH = 0,5(pKa - lgc(HB)).
Сила оснований определяется их способностью принимать протон.
Мерой этой способности служит константа основности (Kb). Для произвольного основания в растворе функцию кислоты выполняет вода:

Приложение закона разведения Оствальда к растворам слабых оснований, способных принять только один протон, дает возможность определить в таких растворах концентрацию гидроксид-ионов: c(OH-) = 
ния получаем: pOH = 0,5(pKb - lgc(B)), pH = pKw - 0,5(pKb - lgc(B)), где pKb - силовой показатель основания (отрицательный десятичный логарифм).
Константы кислотности и основности в сопряженной паре для водного раствора связаны между собой: Ka • Kb = Kw. Чем сильнее кислота, тем слабее сопряженное ей основание, и наоборот. Уксусная кислота (pKa = 4,76) сильнее, чем HCN (pKa = 9). Следовательно, CN- - более сильное основание, чем CH3COO-. При 298 K в водном растворе сумма силовых показателей кислоты и основания в сопряженной протолитической паре равна 14:

Вопрос №24
Процесс нейтрализации.
Реакциями нейтрализации называются обменные реакции взаимодействия кислот и оснований, в результате которых образуются соль и вода.
Типы реакций нейтрализации:
1) Нейтрализация сильного основания сильной кислотой.
Например: KOH+HNO3=KNO3+H2O дельтаG= -80 кДж/моль
молекулярно-ионное уравнение такой реакции
(H+)+(OH-)=H2O
и отрицательное значение Гиббса показывает, что равновесие практически полностью смещено в сторону образования воды. Наиболее общим случаем реакций нейтрализации является взаимодействие кислот и оснований, различающихся по силе(степени диссоциации). Эти реакции не доходят до конца вследствие протекания обратной реакции гидролиза соли.
2) Нейтрализация слабой кислоты сильным основанием.
Например: HCN+KOH=KCN+H2O
в молекулярном виде:
HCN+(OH-)=(CN-)+H2O
в данном случае реакция обратима.
Также обратимы реакции нейтрализации слабого основания сильной кислотой, а так же реакции нейтрализации слабого основания слабой кислотой.
Реакции нейтрализации лежат в основе метода нейтрализации. Этот метод используют в клинических лабораториях для определения кислотности желуд.сока, буферной емкости плазмы крови. В фармации его применяют для количественного анализа неорганических кислот-соляной, серной, борной и органических кислот-уксусной, бензойной, винной, лимонной, салициловой. В биофармацевтических исследованиях методом нейтрализации определяют рКа кислот и рКб оснований, т.к по значению этих величин можно прогнозировать способность лекарственных преператов проходить через биологические мембраны. Применяют кислотно-основное титрование для определения рКа аминокислот и рКа диссоциирующих групп, входящих в белки. По кривым титрования белков, полученным при двух различных температурах, можно определить число карбоксильных, имидазольных и др.групп. Титрование аминокислот и белков дает возможность определить их изоэлектрические точки.
Процесс гидролиза.
Гидролизом соли называют взаимодействие соли с молекулами воды, приводящее к образованию малодиссоциированных соединений.
Гидролиз-это взаимодействие соли с водой, приводящее к изменению рН.
С точки зрения протолитической теории кислот и оснований гидролиз представляет собой частный случай обратимого кислото-основного равновесия. Процесс гидролиза заключается в переходе протона от молекулы воды к данному иону или от данного иона, в том числе от гидратированного катиона металла к молекуле воды.
В зависимости от природы соли вода выступает либо как кислота, либо как основание, а соль явл соответственно сопряженным основанием или сопряженной кислотой.
Например при гидролизе Na2CO3
(CO3 2-)+HOH=(HCO3-)+(OH-)
основание1 кислота2 кислота1 основание 2
процесс заключается в переходе протона от H2O(кислота2) к (CO3 2-)(сопряженное осн.1)
Возможны 4 варианта гидролиза в зависимости от типа соли:
1) соли, образованные сильной кислотой и слабым основанием.
например: NH4CL+HOH=NH3*H2O+HCL
(NH4+)+HOH=NH3+(H3O+) (pH меньше 7)
2) Соли, образованные сильным основанием и слабой кислотой.
например: CH3COONa+HOH=CH3COOH+NaOH
(CH3COO-)+HOH=CH3COOH+(OH-) (pH больше 7)
Из примеров видно, что реакция среды в результате гидролиза определяется тем продуктом, который явл более сильным электролитом.
3) Соли, образованные слабой кислотой и слабым основанием.
например, аммоний цианид гидролизуется по реакции
NH4CN+HOH=NH3*H2O+HCN
(NH4+)+(CN-)+HOH=NH3*H2O+HCN (pH больше 7)
4) Соли, образованные сильной кислотой и сильным основанием. (NaCL, KNO3)
Гидролизу не подвергаются. Это связано с тем, что ионы таких солей не образуют с ионами воды малодиссоциированные соединения. В этом случае равновесие диссоциации воды в присутствии соли почти не нарушается, и растворы практически нейтральны. (pH=7)
Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболочкой. Чем сильнее это взаимодействие, тем интенсивнее протекает гидролиз. Все рассмотренные случаи гидролиза касались солей, образованных однокислотными основаниями и одноосновными кислотами. Соли многоосновных кислот и многокислотных оснований гидролизуется ступенчато, образуя при этом кислые и основные соли. Соли Na2CO3, K3PO4-гидролизуются ступенчато, образуя кислые соли.
Соли AlCl3, Cu(NO3)2, CrCl3 гидролизуются ступенчато с образованием на промежуточных стадиях основных солей.
Гидролиз характеризуется степенью гидролиза и константой гидролиза Кгидр
Степень гидролиза измеряется отношением количества гидролизованного вещества к общему количеству растворенного вещества:
α гидр= n гидр/
где n гидр-количество гидролизованной соли, моль; no-общее количесво растворенной соли, моль.
Степень гидролиза выражают в долях или %. Степень гидролиза зависит от природы соли, её концентрации и температуры. Согласно закону деств.масс, степень гидролиза возрастает с разбавлением раствора. Т.к реакция нейтрализации экзотермична, то противоположный ей процесс гидролиза явл эндотермическим. Эндотермический процесс требует затрат энергии. Повышение температуры приводит к увеличению степени гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
Чем выше константа гидролиза, тем степень гидролиза больше.
Кгидр=Кводы
Кдис слаб.осн.
Примеры:
1) соли, образованной слабой кислотой и сильным основанием
 где
где  — константа диссоциации слабой кислоты, образующейся при гидролизе.
— константа диссоциации слабой кислоты, образующейся при гидролизе.
2) с оли, образованной сильной кислотой и слабым основанием:
 где
где  - константа диссоциации слабого основания, образующегося при гидролизе
- константа диссоциации слабого основания, образующегося при гидролизе
3) соли, образованной слабой кислотой и слабым основанием:

Для гидролиза справедливо:
1) гидролиз соли должен усиливаться с повышением температуры и разбавлении раствора. Для ослабления гидролиза растворы следует хранить концентрированными при низких температурах.
2) при обратимом гидролизе в соответствии с принципом Ле Шателье процесс должен подавляться при подкислении(если эта соль образована сильной кислотой и слабым основанием, накапливаются ионы Н+) или при подщелачивании(если соль образована слабой кислотой и сильным основанием, накапливаются ионы ОН-)
3) гидролиз солей, в результате которого образуются малорастворимые или газообразные продукты, удаляющиеся из сферы реакции(принцип смешивания равновесия), необратим.
Вопрос №26
Многие электролиты, в частности гидроксиды различных элементов, проявляют свойства кислот или оснований. диссоциация гидроксида ЭОН может протекать по двум типам:
Э – О – Н = (ЭО-) + (Н+) (кислотный гидроксид)
разрыв связи между О – Н
Э – О – Н = (Э+) + (ОН-) (основной гидроксид)
разрыв связи между Э – О
Полярность и прочность связей зависит от разности электроотрицательностей элементов, размера и эффективного заряда атома. Если энергия разрыва О – Н значительно меньше энергии разрыва связи Э – О, то диссоция гидроксида протекает по кислотному типу. Если же наоборот, то диссоциация протекает по основному типу. При сравнимой прочности связей О – Н и Э – О диссоциация одновременно может протекать по кислотному и основному типам:
(Н+) + (ЭО-) = ЭОН = (Э+) + (ОН-)
гидроксиды такого типа называются АМФОЛИТАМИ.
амфолитом(амфотерным гидроксидом) называют электролит, диссоциирующий в растворе с образованием как водород-ионов, так и гидроксид-ионов. (цинк, алюминий, хром и др. амфотерные Э, аминокислоты, белки, нукл. Кислоты)
По принципу Ле Шателье
(Н+)+(ЭО-)=ЭОН=(Э+)+(ОН-)
показывает, что с увеличение в системе концентрации гидроксид-ионов (ОН-) возрастает вероятность диссоциации по кислотному типу. Увеличение в системе концентрации водород-ионов (Н+) приводит к преимущественной диссоциации по основному типу.
=> в кислой среде амфолит проявляет основной, а в щелочной среде-кислотный характер.
Например, цинк гидроксид при взаимодействии с кислотами ведет себя как основание:
Zn(OH)2+2HCL=ZnCL2+2H2O
а при взаимодействии со щелочами-как кислота (Zn(OH)2 или H2ZnO2)
Zn(OH)2+2NaOH=Na2[Zn(OH)4]
Процесс ионизации(диссоциации)
Распад молекул электролитов на ионы в растворителях называется электролитической диссоциацией (ионизацией).
Процесс диссоциации обратим(справедливо для слабых электролитов).
Следовательно, в результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость.
Как же происходит процесс растворения?. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Теорию электролитической диссоциации создал в 1884-1887 гг. шведский химик Аррениус.Эта классическая теория позволила как электропроводимость расплавов и растворов, так и протекание химических реакций в растворах между расплавленными или растворёнными веществами.
Схема электролитической диссоциации.

Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным-к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности
Уравнение диссоциации можно записать следующим образом:NaCl Na+ + Cl-
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как Жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко.
Свободные ионы, оказавшиеся в водном растворе окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации.
Вопрос №27
Электронные оболочки атомов и периодический закон Д.И. Менделеева.
Во всех атомах, кроме водорода, электроны взаимодействуют не только с ядром, но и друг с другом. Такое взаимодействие приводит к тому, что происходит их распределение по разным квантовым состояниям. Это распределение определяет строение или конфигурацию электронных оболочек атомов. Конфигурация электронной оболочки произвольного атома можно определить путем «заполнения» квантовых состояний одноэлектронного иона на основе принципов или правил заполнения, предложенных В. Паули.
При построении электронной конфигурации удобно любую орбиталь и соответствующий ей уровень изображать с помощью кружка и черты или квадрата и черты. Это так называемая квантовая ячейка. Кружок с чертой символически обозначает энергетический уровень и соответствующую ему атомную орбиталь. Но и такую энергетическую диаграмму можно упростить, изобразив каждое квантовое состояние (ячейку) одной чертой.
Электронную конфигурацию произвольного атома получают, «заполняя» диаграмму состояний электронами по методу Паули с помощью следующих трех правил:
• принцип минимума энергии: электроны в невозбужденном атоме распределяются по квантовым состояниям таким образом, чтобы суммарная энергия атома Еат была минимальна: Еат = Enlm->min. Конфигурация, при которой атом обладает минимальной энергией, называют основным или невозбужденным состоянием атома.
• принцип Паули: на одной атомной орбитали (в одной квантовой ячейке) не может быть более двух электронов. В соответствии с принципом Паули на энергетической диаграмме состояний.

лений в ячейке изображают электроны с разными значениями спинового квантового числа.
• правило Гунда: при наличии нескольких пустых или наполовину заполненных ячеек данного подуровня электроны занимают максимально возможное число пустых ячеек.

Электронную оболочку атомов изображают с помощью орбиталей.

Великий русский ученый Д.И. Менделеев(1834-1907) открыл в 1869 г закон периодичности свойств элементов-один из важнейших законов природы. В современной формулировке периодический закон элементов Д.И. Менделеев гласит:
свойства элементов и их однотипных соединений находятся в периодической зависимости от заряда атомных ядер элементов.
Периодический закон выводится на основе построения электронных оболочек атомов с помощью квантово-механических правил. Последовательно строятся электронные оболочки атомов у увеличением относительного заряда ядра Z (зарядного числа атома). На основе квантово-механических законов можно построить электронные оболочки атомов всех элементов. Сравнение полученных электронных конфигураций атомов приводит к следующим теоретическим выводам:
1) Строение внешней электронной оболочки атома является периодической функцией зарядового числа атома Z
2) Поскольку химические свойства атома определяются строением внешней оболочки, из предыдущего пункта следует: химические свойства элементов находятся в периодической зависимости от заряда ядра. Таким образом, содержание периодического закона доказано. Этот сам по себе весьма важный результат-не единственное следствие принципов квантовой механики.
3) Номер периодав системе элементов Д.И. Менделеева равен главному квантовому числу n энергетического уровня внешних n-орбиталей, заполняемых в этом периоде. Таким образом, по электронной формуле внешней оболочки атома можно определить, к какому периоду относится элемент, если даже о свойствах этого элемента ничего не известно.
4) Число элементов в периоде, т.е. его длина, равно удвоенному числу внешних квантовых ячеек (орбиталей), заполняемых в этом периоде.
5) В одну группу периодической системы входят элементы с однотипной электронной конфигурацией внешней оболочки атома.
Очевидно, что именно однотипная структура наружних электронных оболочек предопределяет близость свойств элемента, входящих в одну группу.
Природа химической связи и строение химических соединений.
Разработка современной модели атома и предсказание на ее основе свойств индивидуальных атомов - очень важные достижения квантовой механики. Однако в земных условиях редко встречаются изолированные атомы. Окружающие нас тела неживой и живой природы состоят из разнообразных молекул.
Молекулы - наименьшие частицы вещества, которые состоят из двух атомов и более и определяют химические свойства вещества.
Живые организмы построены из самых разнообразных молекул.
Химиков всегда интересовал вопрос, почему одни атомы соединяются в молекулы, другие нет? Почему одни вещества устойчивы, другие быстро распадаются? Почему все молекулы даже самого сложного вещества одинаковы?
На многие из этих вопросов ответил выдающийся русский химик А.М. Бутлеров (1828-1886), создавший теорию химического строения органических веществ (1861). С этого времени в химию начинают постепенно входить понятия валентност ь и химическая связь.
Валентностью называют способность атома присоединять определенное число других атомов с образованием молекулы.
Химической связью называют совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулу. Свойства химической связи изучают различными методами (с помощью химических методов определяют число связей атомов (валентность) и их реакционную способность.
Основные положения этой теории кратко можно сформулировать так:
1) химическая связь обладает специфической особенностью – насыщаемостью, поэтому валентность элемента выражается числом связей его атома;
2) единицы химической связи обозначаются черточками.
 Например СН4
Например СН4
3) химическая природа вещества зависит от его строения и, наоборот, определенному строению отвечает определенная совокупность свойств;
Итак, валентонсть отражает форму химического взаимодействия элементов, а химическая связь – его содержание.
С помощью физических методов определяют длину, прочность, ориентацию и полярность химических связей:
Длиной химической связи rc называют величину, измеряемую расстоянием между ядрами связываемых атомов.
В качестве единицы измерения длины химической связи удобно использовать пикометр(ПМ) 1ПМ=10(-12)м.
Химическая связь образуется в результате частичного перекрывания валентных орби-талей. Очевидно, что длина связи rс должна быть примерно равной сумме орбитальных радиусов, связываемых атомы А и В: rc(A - В) =
= rорб.(А)+ rорб.(В).
Прочность химической связи Ес - величина, измеряемая энтальпией ΔHc образования связи. В качестве единицы измерения прочности химической связи Ес используют кДж/моль.
Ориентация химической связи αс - величина, измеряемая углом между направлениями связей данного атома с соседними атомами молекулы. Угол αс называют валентным. Единица измерения валентного угла αс - градус. Значение αс может меняться в пределах от 80 до 180°.
Полярность химической связи μс - величина, измеряемая электрическим моментом данной связи. Электрический момент для двух электрических зарядов +q и - q, равных по абсолютному значению и противоположных по знаку, равен qr, где r - расстояние между
зарядами.Такие два заряда образуют электрический диполь:

Химическая связь поляризуется, когда связываются два атома с разной электроотрицательностью (ОЭО). В результате на атоме с большим значением ОЭО возникает избыточный отрицательный заряд, а на другом атоме с меньшим значением ОЭО - избыточный положительный заряд.
В качестве единицы измерения полярности химической связи принято использовать внесистемную единицу Дебай 1 D = 3,3•10-30 Кл•м. Полярность О-Н связи в молекуле воды равна μ(Н20) = 1,5 D.
Квантово-механические расчеты характеристик различных химических связей позволяют сформулировать следующие два основных положения метода валентных связей о природе химической связи:
1) химическая связь между двумя атомами, которая возникает в результате перекрывания внешних атомных орбиталей и путем обобщения электронов, находящихся на этих орбиталях, называют ковалентной;
2) характеристики химической связи (Ес, rс, αс, μс) и ее природа определяются типом перекрывающихся орбиталей атомов.
Вопрос №28
КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
Изучение атомных орбиталей, рассчитанных с помощью уравнения Шредингера, показало, что характер движения электрона в атоме определяется четырьмя числами - n, l, m, s, получившими общее название квантовых чисел: главное, орбитальное, магнитное и спиновое.
Главное квантовое число n. Это число может принимать любые положительные целочисленные значения: n = 1, 2, 3. Определяет орбитальный радиус и соответствующий главный энергетический уровень En. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Орбитальным радиусом rорб называют расстояние от ядра атома до наиболее удаленной точки поверхности, изображающей атомную орбиталь. Для сферической поверхности орбитальный радиус равен радиусу сферы. Для поверхности в виде песочных часов орбитальный радиус равен диаметру одной из составляющих сфер.
Главным энергетическим уровнем называют часть энергии атома, определяемой главным квантовым числом n.

Энергия притяжения между электроном и ядром уменьшается обратно пропорционально квадрату главного квантового числа n2, а орбитальный радиус rорб увеличивается пропорционально этой величине. С увеличением числа п электрон в среднем находится все дальше от ядра. При п → ∞ энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома.
Таким образом, главные энергетические уровни Еп атома можно определять экспериментально измерением минимальной энергии, необходимой для отрыва электрона от атома. Определяемая таким способом величина называется энергией ионизации атома - I. Это очень важная характеристика атома, от которой зависят его свойства, в частности электроотрицательность. Еп уменьшается с возрастанием главного квантового числа п и орбитального радиуса rорб.
Орбитальное квантовое число l. Число l может принимать целочисленные значения: l = 0, 1, 2, n - 1, т.е. максимальное значение l не превышает n- 1, где n - главное квантовое число.
Величина l определяет форму атомной орбитали и орбитальный подуровень энергии Enl - главного энергетического уровня атома при данном n. При l = 0 форма орбитали сферическая и называется s-орбиталью. При l = 1 орбиталь имеет форму песочных часов (гантели) и называется р-орбиталью. При l = 2 форма орбитали четырехлопастная и называется d-орбиталью.
У р-орбиталей имеется узел, а у d-орбиталей узловые плоскости, где волновые функции равны нулю. Знаки лопастей чередуются. При n = 1 имеется только одна s-орбиталь и отсутствуют другие подуровни энергии и орбитали. При n = 2 имеются 2s (l = 0)- и 2р (l = 1)-орбитали разной ориентации. Им соответствуют энергетические подуровни Е2s" Е2р. При n = 3 имеются одна 3s (l = 0)-, 3р (l = 1)- и 3d (l = 2)-орбитали разных ориентаций. Им соответствуют энергетические подуровни E3s, Е3p' E3d.

Размер атомных орбиталей разной формы возрастает с увеличением n.
Магнитное квантовое число m. Число m принимает целочисленные значения: 0, ±1, ±2, ±l. Определяют ориентацию орбиталей в пространстве, их число на данном орбитальном подуровне Enl и магнитный энергетический подуровень Enlm. На каждом орбитальном подуровне Е (l = 1) имеется три пр-орбитали с ориентацией вдоль осей х, у, z. Например, при n= 2 подуровню E2l(l = 1) соответствуют орбитали 2рх(m = ±1), 2ру(m = -1) и 2рz(m = 0) (рис. 3.3).
При n = 3 подуровню Е31 (l = 2) отвечают пять орбиталей разных ориентаций.

Ориентация р-атомных орбиталей при разных значениях магнитного квантового числа m.
Спиновое квантовое число s. Число s принимает два значения: +0,5 и -0,5. Характеризует собственное вращательное движение электрона. На каждой атомной орбитали двум значениям S = ± 0,5 отвечает вращение по часовой и против часовой стрелки. Соответственно имеются два спиновых подуровня энергии Enlms.
Четыре квантовых числа n, l, m, s характеризуют различные типы пространственного квантования при движении одного электрона в атоме и определяют соответствующие квантовые энергетические уровни.
Орбиталь φnlm и соответствующий энергетический уровень Enlm, определяемый четырьмя квантовыми числами n, l, m, s, называют квантовым состоянием электрона в атоме.
Электронные формулы и электронно-структурные схемы атомов.
Электронная формула описывает распределение электронов по энергетическим уровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома.
Расшифровка электронной конфигурации
По историческим причинам в формуле электронной конфигурации квантовое число  записывается латинской буквой. Состояние с
записывается латинской буквой. Состояние с  обозначается буквой
обозначается буквой  ,
, 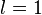 —
—  ,
, 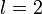 —
—  ,
,  —
—  ,
,  —
—  и далее по алфавиту. Слева от числа
и далее по алфавиту. Слева от числа  пишут число
пишут число 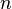 , а сверху от числа
, а сверху от числа  — число электронов в состоянии с данными
— число электронов в состоянии с данными 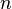 и
и  . Например
. Например  соответствует двум электронам в состоянии с
соответствует двум электронам в состоянии с  ,
,  . Из-за практического удобства (см. правило Клечковского) в полной формуле электронной конфигурации термы пишут в порядке возрастания квантового числа
. Из-за практического удобства (см. правило Клечковского) в полной формуле электронной конфигурации термы пишут в порядке возрастания квантового числа 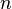 , а затем квантового числа
, а затем квантового числа  , например
, например  . Поскольку такая запись несколько избыточна, иногда формулу сокращают до
. Поскольку такая запись несколько избыточна, иногда формулу сокращают до  , т. е. опускают число там, где его можно угадать из правила упорядочения термов.
, т. е. опускают число там, где его можно угадать из правила упорядочения термов.
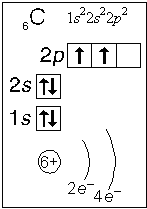
Наиболее просто электронная конфигурация представляется в виде электронной формулы атома. Для этого символы заполненных квантовых ячеек записывают в одну строчку с показателем степени, равным числу электронов в ячейке. Символы ячеек записывают в порядке повышения энергетических уровней. Например, для атома азота электронная формула оболочки имеет вид: N - 1s22s22px2py2pz, или еще короче: N - 1s22s22p3. Очевидно, что сумма степеней при символах должна равняться числу электронов Z в оболочке или номеру элемента. Для азота (Z = 7) эта сумма равна 2 + 2 + 3 = 7. Существенно, что в электронной формуле атома, как и в энергетической диаграмме, отображена последовательность расположения энергетических уровней по высоте: ls < 2s < 3s.
При поглощении энергии один или несколько электронов атома могут перейти на более высокие энергетические уровни. Такой атом называется возбужденным. В возбужденном атоме электроны занимают новые квантовые ячейки, уже не подчиняясь принципу минимальной энергии. Соответственно изменяются энергетические диаграммы и электронные формулы. Для примера - переход атома углерода из основного состояния С - 1s22s22p2 в возбужденное С* - 1s22s12p3.
Распределение электронов атома по уровням, подуровням и орбиталям (электронная конфигурация атома) может быть изображена в виде электронной формулы, энергетической диаграммы или, упрощенно, в виде схемы электронных слоев ("электронная схема").