Тема урока: «Решение расчетных задач на смеси металлов»
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
Решение примера 1.
- Находим количество водорода:
 моль.
моль. - По уравнению реакции:

Количество железа тоже 0,25 моль. Можно найти его массу:
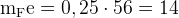 г.
г.
- Теперь можно рассчитать массовые доли металлов в смеси:
w{Fe} = mFe/mCM = 14 / 20 = 0,7 = 70 %
Ответ: 70 % железа, 30 % меди.
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за x — число моль одного из металлов, а за y — количество вещества второго.
Решение примера 2.
- Находим количество водорода:
 моль.
моль. - Пусть количество алюминия —
 моль, а железа
моль, а железа  моль. Тогда можно выразить через
моль. Тогда можно выразить через  и
и  количество выделившегося водорода:
количество выделившегося водорода:

 – мольное соотношение
– мольное соотношение 
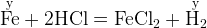
3.Нам известно общее количество водорода: 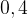 моль. Значит,
моль. Значит, 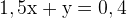 (это первое уравнение в системе).
(это первое уравнение в системе).
4.Для смеси металлов нужно выразить массы через количества веществ. 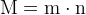 Значит, масса алюминия
Значит, масса алюминия
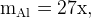
масса железа

а масса всей смеси
 (это второе уравнение в системе).
(это второе уравнение в системе).
5.Итак, мы имеем систему из двух уравнений:
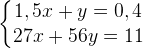
Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18: 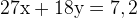 и вычитая первое уравнение из второго:
и вычитая первое уравнение из второго:
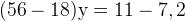
 моль
моль 
 моль
моль 
6.Дальше находим массы металлов и их массовые доли в смеси:
 г
г
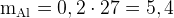 г
г
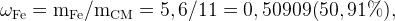
соответственно,
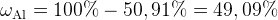
Ответ: 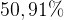 железа,
железа, 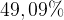 алюминия.
алюминия.
Для сдающих ОГЭ
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Задачи для самостоятельного решения
1.Смесь магния и серебра массой 7,2г обработали достаточным количеством разбавленной серной кислоты. Объем выделившегося газа составил 2.24л (н.у.). Рассчитайте массовую долю(в%) каждого металла в смеси.
2. Смесь алюминия и меди массой 6г обработали соляной кислотой. Объем выделившегося газа составил 3,7л (н.у.). Рассчитайте массовую долю (в%) каждого металла в смеси.
3. При взаимодействии 9,2г смеси порошков алюминия и цинка с раствором соляной кислоты выделился газ объемом 5,6л (н.у.). Определите количественный состав исходной смеси.