Технология серной кислоты
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это и тем, что она самая дешевая из всех кислот, а также ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от - 40...-20 до 260-336,5 оС) находится в жидком состоянии.
Области применения серной кислоты чрезвычайно обширны. Существенная ее часть используется как полупродукт в различных отраслях химической промышленности, прежде всего для получения минеральных удобрений, а также солей, кислот, взрывчатых веществ. Серная кислота применяется и при производстве красителей, химических волокон, в металлургической, текстильной, пищевой промышленности и т. д.
Сырье для серной кислоты и методы ее получения
Исходными реагентами для получения серной кислоты могут быть элементная сера и серосодержащие соединения, из которых можно получить либо серу, либо диоксид серы. Такими соединениями являются сульфиды железа, сульфиды цветных металлов (меди, цинка и др.), сероводород и ряд других сернистых соединений. Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты получают из серы, треть - из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В целях защиты окружающей среды во всем мире принимаются меры по использованию отходов промышленности, содержащих серу.
В то же время отходящие газы - наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
Получение серной кислоты включает несколько этапов.
Первым этапом является получение диоксида серы окислением (обжигом) серосодержащего сырья.
Следующий этап - превращение оксида серы (IV) в оксид серы (VI). Этот окислительный процесс характеризуется очень высоким значением энергии активации, для понижения которой необходимо, как правило, применение катализаторов. В зависимости от того, как осуществляется процесс окисления SО2 в SО3, различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SО2 и SО3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса - абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции
SO3 + H2O → H2SO4.
Контактный метод получения серной кислоты
Рассмотрим процесс получения серной кислоты контактным методом из серного (железного) колчедана. Первой стадией процесса является окисление серного колчедана с получением обжигового газа, содержащего диоксид серы.
Обжиг колчедана (пирита) является сложным физико-химическим процессом и включает в себя ряд последовательно или одновременно протекающих реакций:
Термическая диссоциация
FeS2 = 2FeS + S2;
Парофазное горение серы
S2 + 2О2 = 2SО2;
Горение пирротина
FeS + 7О2 = 2Fе2О3 + 4SО2.
Суммарная реакция:
FеS2 + 11O2 = 2Fе2О3 + 8SО2. (I)
При небольшом избытке или недостатке кислорода образуется смешанный оксид железа:
FеS2 + 8О2 = Fе3О4 + 6SО2.
Термическое разложение пирита начинается уже при температуре около 200 оС и одновременно воспламеняется сера. При температурах выше 680 °С интенсивно протекают все три реакции. В промышленности обжиг ведут при 850 - 900 °С. Лимитирующей стадией процесса становится массоперенос продуктов разложения в газовую фазу и окислителя к месту реакции. При тех же температурах твердый компонент размягчается, что способствует слипанию его частиц.
Реакция окисления SO2 экзотермична; тепловой эффект ее, как и любой химической реакции, зависит от температуры. В интервале 400-700 °С тепловой эффект реакции окисления (в кДж/моль) с достаточной для технических расчетов точностью может быть вычислен по формуле
Q= 10 142 -9.26Т или 24 205 - 2,21Т (в ккал/моль)
где Т - температура, К.
Реакция окисления SO2 в SO3 обратима. Константа равновесия этой реакции (в Па-0.5) описывается уравнением

где Pso3, Pso2, Po2-равновесные парциальные давления SO3, SO2 и O2, Па.
Величина Кр зависит от температуры. Значения Kр в интервале 390-650°С могут быть вычислены по формуле
lgKp = 4905/T - 7,1479
Степень превращения SO2, достигаемая на катализаторе, зависит от его активности, состава газа, продолжительности контакта газа с катализатором, давления и др. Для газа данного состава теоретически возможная, т. е. равновесная степень превращения, зависит от температуры и выражается уравнением

В производственных условиях существенное значение имеет скорость окисления SO2. От скорости этой реакции зависит количество диоксида серы, окисляющегося в единицу времени на единице массы катализатора, и, следовательно, расход катализатора, размеры контактного аппарата и другие технико-экономические показатели процесса. Процесс стремятся вести так, чтобы скорость окисления SO2, а также степень превращения были возможно более высокие.
Скорость окисления SO2 характеризуется константой скорости

где k0 -коэффициент; Е - энергия активации, Дж/моль; R -универсальная газовая постоянная, 8,31 Дж/(моль-К); Т - абсолютная температура, К.
Из кинетической теории газов известно, что доля молекул, обладающих энергией, достаточной для того, чтобы при их столкновении произошла реакция, составляет в первом приближении e~E/RT. Таким образом, этот член в уравнении скорости реакции характеризует долю эффективных столкновений, приводящих к образованию молекул SO3. Показатель степени в выражении e~ElRT отрицателен; следовательно, с повышением температуры скорость реакции возрастает, а с увеличением Е уменьшается.
Энергия активации Е реакции окисления SO2 в SO3 очень велика, поэтому без катализатора реакция гомогенного окисления практически не идет даже при высокой температуре. В присутствии твердых катализаторов энергия активации понижается, следовательно, скорость гетерогенной каталитической реакции возрастает. Таким образом, роль катализатора состоит в понижении энергии активации Е.
Важнейшей задачей в производстве серной кислоты является повышение степени превращения SО2 в SО3. Помимо увеличения производительности по серной кислоте выполнение этой задачи позволяет решить и экологические проблемы - снизить выбросы в окружающую среду вредного компонента SО2,.
Повышение степени превращения SО2 может быть достигнуто разными путями. Наиболее распространенный из них - создание схем двойного контактирования и двойной абсорбции (ДКДА).
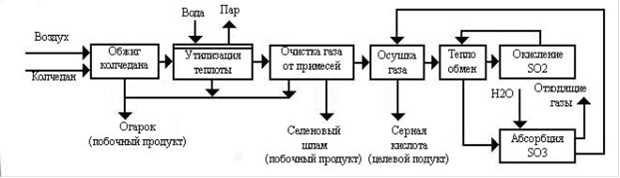
Рис.1. Функциональная схема производства серной кислоты из колчедана методом одинарного контактирования.
Исходные данные
Производительность, т/ч H2SO4 10
Концентрация, об. доли:
SO2 в газе 0,082
O2 в газе 0,1
Объемный расход газа V,м3/ч 30800 (8,56м3/c)
Конечная степень превращения 0,98
Общее давление, атм. 1
Расчетная часть
серный кислота колчедан контактный
Четырехслойный контактный аппарат с промежуточным теплообменом загружен гранулированной контактной массой и работает по следующему режиму:
Температура газа на входе в слой
| I | II | II | IV |
Степень превращения, Х
| IIIIIIIV | |||
| 0,72 | 0,92 | 0,97 | 0,98 |
Коэффициент запаса катализатора, С
| IIIIIIIV | |||
| 1,3 | 1,35 |
Требуемый объем контактной массы для каждого слоя находим по уравнению
υ=сVτ
Так как значение С известно, а величина V дается по условию, то для определения контактной массы необходимо установить время контакта τ для каждого слоя, а затем и для всего контактного аппарата.
Чтобы определить τ воспользуемся постадийным методом. Принимая для каждого участка dτ = ∆τ и dx = ∆x, уравнение


можно записать в виде
∆τ = ∆x * Z
Просуммировав полученные значения ∆τ для каждого участка, находят время для всего слоя по уравнению

где n - число участков.
Для практических расчетов окисления SO2 на ванадиевом катализаторе можно принять следующие значения E и k0.
| t | x | E | k0 |
| <440 | >0,6 | 3,74*10^14 | |
| 440-530 | >0,6 | 0,225 | |
| >530 | >0,6 | 2,79*10^(-5) |
1. Расчет первого слоя.Слой разбиваем на 5 участков; степень превращения х в каждом участке принимаем соответственно 0,14; 0,34; 0,54; 0,66; и 0,72. Для 1-го участка имеем: а=0,074, b= 0,1, x= 0,14, ∆x= 0,14, коэффициент λ=212, t1н=440 °С.
Тк = Тн + λ∆x = 440 + 212*0,14 = 470 °С
При t1к= 470 °С значение Е=59871 и k0=0,225

k= 0,225*exp(-59871/8,31(470+273))= 1,38*10-5
Константу равновесия определим по формуле
lgKp = 4905,5/T - 7,1479
lgKp = 4905,5/(470+273) - 7,1479 = - 0, 548
Kp= 0,285


В таблицах, приведенных ниже, результаты расчета остальных участков 1 слоя, а также 2-4 слоев, разделенных на 4, 3 и 3 участка соответственно.
С увеличением участков на каждом слое общее время контакта τ уменьшается.
Слой
| Tн | Tк | к | lgКр | Kp | Δx | β | Δτ | x | |
| 1 участок | 1,38E-05 | -0,546 | 0,285 | 0,14 | 0,09480 | 0,099 | 0,14 | ||
| 2 участок | 2,35E-05 | -0,907 | 0,124 | 0,2 | 0,08728 | 0,113 | 0,34 | ||
| 3 участок | 2,79E-05 | -1,231 | 0,059 | 0,2 | 0,07962 | 0,151 | 0,54 | ||
| 4 участок | 2,79E-05 | -1,410 | 0,039 | 0,12 | 0,07497 | 0,180 | 0,66 | ||
| 5 участок | 2,79E-05 | -1,496 | 0,032 | 0,06 | 0,07262 | 0,710 | 0,72 |
∑τ=1,253с.
Слой
| TнTккlgКрKpΔxβΔτx | |||||||||
| 1 участок | 1,35E-05 | -0,528 | 0,297 | 0,07 | 0,06987 | 0,250 | 0,79 | ||
| 2 участок | 1,68E-05 | -0,676 | 0,211 | 0,08 | 0,06671 | 0,439 | 0,87 | ||
| 3 участок | 1,81E-05 | -0,727 | 0,187 | 0,03 | 0,06552 | 0,263 | 0,9 | ||
| 4 участок | 1,90E-05 | -0,761 | 0,174 | 0,02 | 0,06472 | 0,424 | 0,92 |
∑τ=1,376с.
Слой
| TнTккlgКрKpΔxβΔτx | |||||||||
| 1 участок | 9,33E-06 | -0,277 | 0,528 | 0,03 | 0,06352 | 0,845 | 0,95 | ||
| 2 участок | 9,73E-06 | -0,306 | 0,494 | 0,012 | 0,06304 | 0,584 | 0,962 | ||
| 3 участок | 1,00E-05 | -0,325 | 0,473 | 0,008 | 0,06272 | 1,102 | 0,97 |
∑τ=2,531с.
Слой
| TнTккlgКрKpΔxβΔτx | |||||||||
| 1 участок | 4,40E-06 | -0,170 | 0,676 | 0,005 | 0,06252 | 1,026 | 0,975 | ||
| 2 участок | 4,69E-06 | -0,180 | 0,661 | 0,003 | 0,06240 | 1,117 | 0,978 | ||
| 3 участок | 4,69E-06 | -0,180 | 0,661 | 0,002 | 0,06232 | 1,910 | 0,98 |
∑τ=4,053с.
. Объем контактной массы определяем по уравнению υ=сVτ, принимая значение коэффициента запаса в соответствии с вышеприведенными данными:
| ν | ν,% | |
| ν1 | 42,91 | 13,603 |
| ν2 | 47,11 | 14,936 |
| ν3 | 86,66 | 27,472 |
| ν4 | 138,76 | 43,989 |
| ∑ν | 315,44 |
Или в расчете на 1 т/ч Н2SO4:

Если не учитывать изменение объема газа в результате окисления SO2 и принять w= 0,3м/с, то после подстановки в уравнение
 ,
,
получим:
 м2.
м2.
Внутренний диаметр контактного аппарата равен:

Высота слоев контактной массы составит:
h= υ / F
| h1 | 1,50 |
| h2 | 1,65 |
| h3 | 3,04 |
| h4 | 4,87 |
Общая высота всех слоев: Н=11,06м.
3. Скорость газа и его плотность при средней температуре равны:
wt= w*((tcp + 273)/2+273)/273
ρ= 1,4*273/(tcp + 273)
Результаты расчета:
| w1 | 0,869 |
| w2 | 0,821 |
| w3 | 0,784 |
| w4 | 0,773 |
| ρ1 | 0,483 |
| ρ 2 | 0,512 |
| ρ 3 | 0,536 |
| ρ 4 | 0,544 |
Гидравлическое сопротивление слоев контактной массы определяется по формуле:
Для массы БАВ с гранулами диаметром 5мм значение А=500.
Δp= 9,8*A*w1,74 ρ*h
Результаты расчета:
| p1 | 2790,181 |
| p2 | 2776,144 |
| p3 | 4714,514 |
| p4 | 7356,819 |
Общее гидравлическое сопротивление контактной массы составит:
∑p=17637,66 Па.
Заключение
Принятые в данном расчете температура газа на входе в каждый слой и степень превращения как после каждого слоя, так и после каждого участка, установлены путем предварительных расчетов таким образом, чтобы общее время контакта для всего контактного аппарата (для четырех слоев) приближалось к минимальному значению.