Электролитическая диссоциация.
В 1887 году шведский физико - химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы.
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которую часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении.
Основные положения теории:
1. Электролиты в растворах под действием растворителя самопроизвольно распадаются на ионы. Такой процесс называется электролитической диссоциацией. Диссоциация также может проходить при расплавлении твердых электролитов.
2. Ионы отличаются от атомов по составу и свойствам. В водных растворах ионы находятся в гидратированном состоянии. Ионы в гидратированном состоянии отличаются по свойствам от ионов в газообразном состоянии вещества. Это объясняется так: в ионных соединениях уже изначально присутствуют катионы и анионы.
3. В растворах или расплавах электролитов ионы движутся хаотично, но при пропускании электрического тока ионы движутся направленно: катионы – к катоду, анионы – к аноду.
К электролитам относятся кислоты, основания и соли. В свете теории электролитической диссоциации можно дать им определения.
Основания – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов: гидроксид-анион: OH-.
NaOH ↔ Na+ + OH−
Диссоциация оснований, содержащих несколько гидроксильных групп, происходит ступенчато:
Ba(OH)2↔ Ba(ОН)+ + OH− Первая ступень
Ba(OH)+ ↔ Ba2+ + OH− Вторая ступень
Ba(OH)2↔ Ba2+ + 2 OH− Суммарное уравнение
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов: H+. Ионом водорода называют именно гидратированный протон и обозначают H3O+, но для простоты записывают H+.
HNO3↔ H+ + NO3−
Многоосновные кислоты диссоциируют ступенчато:
H3PO4↔ H+ + H2PO4- Первая ступень
H2PO4- ↔ H+ + HPO42- Вторая ступень
HPO42-↔ H+ + PO43- Третья ступень
H3PO4↔ 3H+ + PO43-Суммарное уравнение
Соли – это электролиты, диссоцирующие в водных растворах на катионы металла и анионы кислотного остатка.
Na2SO4 ↔ 2Na+ + SO42−
Средние соли – это электролиты, диссоциирующие в водных растворах на катионы металла или катионы аммония и анионы кислотного остатка.
Основные соли – это электролиты, диссоциирующие в водных растворах на катионы металла, гидроксид анионы и анионы кислотного остатка.
Кислые соли – это электролиты, диссоциирующие в водных растворах на катионы металла, катионы водорода и анионы кислотного остатка.
Двойные соли – это электролиты, диссоциирующие в водных растворах на катионы нескольких металлов и анионы кислотного остатка.
KAl(SO4)2↔ K+ + Al3+ + 2SO42
Смешанные соли – это электролиты, диссоциирующие в водных растворах на катионы металла и анионы нескольких кислотных остатков.
Сила электролитов.
Электролитическая диссоциация в той или иной степени – процесс обратимый. Но при растворении некоторых соединений равновесие диссоциации в значительной степени смещено в сторону диссоциируемой формы. В растворах таких электролитов диссоциация протекает практически необратимо. Такие вещества называют сильными электролитами.
Слабыми называются электролиты, в которых диссоциация происходит незначительно.
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации.
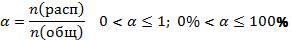
Силу электролита можно охарактеризовать и при помощи константы химического равновесия диссоциации. Называется она константа диссоциации.
При увеличении температуры и разбавлении раствора степень электролитической диссоциации увеличивается. Поэтому оценить силу электролита можно, только сравнивания их при одинаковых условиях. За стандарт принята t = 180С и с = 0,1 моль/л.
| СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ | СЛАБЫЕ ЭЛЕКТРОЛИТЫ |
| Степень диссоциации при 180С в растворах с концентрацией электролита 0,1 моль/л близка к 100%. Диссоциируют практически необратимо. | Степень диссоциации при 180С в растворах с концентрацией электролита 0,1 моль/л значительно меньше 100%. Диссоцииация необратима. |
| · Щелочи (растворимые и малорастворимые основания) · Соли (растворимые) · Неорганические кислоты (НNO3, HClO4,HI, HCl, HBr, HMnO4, H2CrO4, H2SO4) | · Нерастворимые гидроксиды металлов, раствор аммиака · Нерастворимые соли · Неорганические кислоты (НNO2, HClO, HF, H2S, HCN, H2SO3,H2CO3 H2SiO3), органические кислоты (HCOOH, CH3COOH) · Вода |
Реакции ионного обмена
Сущность реакции в растворах электролитов выражается ионным уравнением. В нем учитывается тот факт, что в одном растворе сильные электролиты присутствуют в виде ионов. А слабые электролиты и недиссоциируемые вещества записываются в молекулярной форме.
Реакции в растворах электролитов протекают в направлении связывания ионов.
Существует несколько форм связывания ионов:
1. Образование осадка
2. Выделение газа
3. Образование слабого электролита.
· 1. Образование осадка:
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl.
Ba2++2Cl- + 2Na++CO32-→ BaCO3↓ + 2Na++2Cl- полное ионное уравнение
Ba2+ + CO32-→ BaCO3↓ сокращенное ионное уравнение.
Сокращенное ионное уравнение показывает, что при взаимодействии любого растворимого соединения, содержащего ион Ba2+, с соединением, содержащим карбонат-анион CO32-, в результате получится нерастворимый осадок BaCO3↓.
· 2. Выделение газа:
Na2CO3 +H2SO4 → Na2SO4 + H2O + CO2↑
2Na+ + CO32- +2H++ SO42- → 2Na+ + SO42- + H2O + CO2↑ полное ионное уравнение
2H+ + CO32- → H2O + CO2↑ сокращенное ионное уравнение.
· 3. Образование слабого электролита:
KOH + HBr → KBr + H2O
K+ + OH- + H+ + Br- → K+ + Br- + H2O полное ионное уравнение
OH- + H+ → H2O сокращенное ионное уравнение.
Рассматривая эти примеры, мы убедились, что все реакции в растворах электролитов происходят в направлении связывания ионов.